


БНБ
"БРОКГАУЗ И ЕФРОН" (121188)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Янтарная кислота и ее гомологи
Определение "Янтарная кислота и ее гомологи" в словаре Брокгауза и Ефрона
Янтарная кислота и ее гомологи — представляют предельные двухосновные кислоты общей формулы С n Н 2n (СО 2 Н) 2 = С m Н 2m-2 О 4, заключающие в молекуле группу атомов — 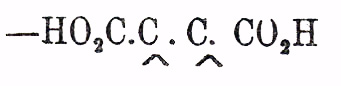 , свободные сродства которой насыщены водородом (Я. кислота) или более или менее сложными одноатомными остатками общей формулы (С nH2n+1)' [гомологи Я. кислоты]. Вполне резких признаков, позволяющих установить наличность указанной группировки в данной двуосновной предельной кислоте, не имеется, и потому о присутствии ее судят главным образом на основании синтетических реакций образования кислоты. Гомологи Я. кислоты отличаются от замещенных малоновых кислот неспособностью распадаться при температуре плавления (и несколько выше) на углекислый газ и одноосновную предельную кислоту. От кислот глутаровых и некоторых других изомерных кислот они отличаются тем, что при перегонке распадаются на воду и ангидрид: С n Н 2n (СО 2 Н) 2 = H2 O + С nH2n(C2O3); последний в бензольном (хлороформенном, эфирном) растворе образует с анилином (п. толуидином, β-нафтиламином) труднорастворимую аниловую кис.
, свободные сродства которой насыщены водородом (Я. кислота) или более или менее сложными одноатомными остатками общей формулы (С nH2n+1)' [гомологи Я. кислоты]. Вполне резких признаков, позволяющих установить наличность указанной группировки в данной двуосновной предельной кислоте, не имеется, и потому о присутствии ее судят главным образом на основании синтетических реакций образования кислоты. Гомологи Я. кислоты отличаются от замещенных малоновых кислот неспособностью распадаться при температуре плавления (и несколько выше) на углекислый газ и одноосновную предельную кислоту. От кислот глутаровых и некоторых других изомерных кислот они отличаются тем, что при перегонке распадаются на воду и ангидрид: С n Н 2n (СО 2 Н) 2 = H2 O + С nH2n(C2O3); последний в бензольном (хлороформенном, эфирном) растворе образует с анилином (п. толуидином, β-нафтиламином) труднорастворимую аниловую кис.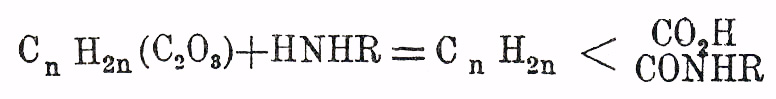
(Anschü tz), переходящую при кратковременном нагревании выше температуры плавления (Auwers), или при водоотнимающем действии хлористого ацетила (фосфорного ангидрида, Ansch ü tz), с потерей воды в анил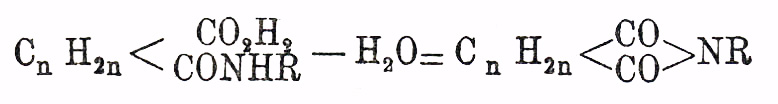
(Anschü tz, Auwers, "L. A.", 261 и 285); глутаровые кислоты большей частью способны перегоняться без разложения и их аниловые кислоты не теряют воды при нагревании; впрочем, как было уже замечено, резкого, качественного различия между реакциями этих изомеров (кислот янтарных и глутаровых) установить невозможно. Реакциями образования Я. кислот признаются: 1) окисление соответственных двупервичных гликолей (см.) [соответственных оксиальдегидов, диальдегидов, первичных спиртокислот, альдегидо-кислот): (НО)Н 2 С.СН 2.СН 2 СН 2 (ОН) + 40" = (НО)ОС.СН 2.СН 2.СО(ОН)+2Н 2 О; 2) гидрогенизация непредельных двуосновных кисл. общей формулы С nH2n-4O4 (см. кислоты: малеиновую, фумаровую, цитраконовую): НО 2 С.СН:СН.СО 2 Н + H 2 = НО 2 С.СН 2.СH 2.СО 2 Н; 3) восстановление (гидрогенизация) соответственных окси-(диокси), или галоидозамещенных двуосновных предельных кислот: НО 2 С.СН(ОН).СН(ОН).СО 2 Н (винная кислота, см.) + 4HJ = НО 2 С.СН 2.СН 2 СО 2 Н + 2Н 2 О + 2J 2, НО 2 С.СH(ОН).СН 2.СО 2 Н (яблочная кислота, см.) + 2HJ = НО 2 С.СН 2.СH 2,. CO2H + H2O + J2 и HO 2C.CHCl.CH2 COH (хлороянтарная кисл.) +Н 2 = НО 2 C.СН 2.СH 2 СО 2 Н + HCl; 4) действие молекулярного серебра (Wislicenus) или ртути (Vandevelde) на моногалоидо (хлоро, но преимущественно бромо-, йодо-) замещенные эфиры предельных одноосновных кислот: H 5C2O2C.CH2 Cl (монохлороуксусный эфир) + Hg + ClCH 2.CO2C2H5 = HgCl2 + Н 5 С 2O2 С.СН 2.СН 2.СО 2 С 2 Н 5 (эфир Я. кислоты); эта реакция наименее чистая и часто ведет к образованию изомерных кисл. Я. и глутаровых; напр. 2Н 5 С 2 О 2 С.СВr(СН 3)2 (бромизомасляный эфир) + 2Ag = Н 5 С 2 О 2 С.СН(СН 3).СН 2.С(СН 3)2.СО 2 С 2 Н 5 (триметилглутаровый эфир) + 2AgBr; 5) действие KCN на моногалоидозамещенные предельные одноосновные кислоты и омыление полученных нитрилов: Н 5 С 2O2 С.СH 2.СН 2 Х (Х = Cl, Вr, J) + KCN=H 5C2O2C.CH2.CH2.CN + КХ и H 5C2O2 C.CН 2 СН 2.CN + 3H2 O = НО 2 С.СH 2 СН 2.СО 2 Н + С 2 Н 5 (ОН) + NH 3; реакция может быть значительно усложнена, так как некоторые цианоэфиры способны замещать водород (один, два атома) металлом (натрием напр.), который может быть, при действии галоидалкилов (C 2H5 J — йодистого этила, напр.) замещен эквивалентным числом одноатомных предельных остатков (С N Н 2n+1) (ср. ниже); 6) омыление соответственных двунитрилов, получаемых в свою очередь при взаимодействии KCN (в спиртовом растворе) с двугалоидоэтиленами (двухлоро- и двубромоэтиленами), т. е. такими двугалоидозамещенными парафинами — С N Н 2N Х 2 —, у которых оба атома галоида (X) находятся у соседних атомов углерода (ср. Этилен, строение): 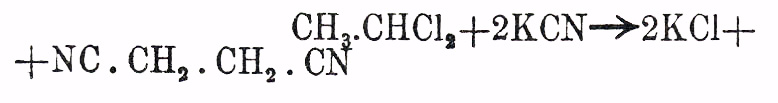 (двунитрил Я. кислоты) и NC.CН 2.CH2.CN + 4Н 2 О = 2NH 3 + НО 2 С.СН 2.СН 2.СО 2 Н; и эта реакция, надо думать, не протекает без перегруппировок; так напр. только что указанный двунитрил может быть получен при действии KCN на хлористый этилиден: CH 3.CHCl2 + 2KCN?2KCl + NC.СН 2.СH 2.CN, т. е. на такое производное, у которого атомы галоида находятся у одного атома углерода (Simpson, Erlenmeyer; ср. Этилен, строение); действие KCN на гомологи хлористого этилидена не изучено систематически; 7) действие α-моногалоидозамещенных эфиров предельных одноосновных кислот на мононатрзамещенные малоновые эфиры, сопровождаемое омылением полученных эфиров и разрушением нагреванием трикарбоновых кислот (см. Трикарболовые и Четырехосновные кисл.):
(двунитрил Я. кислоты) и NC.CН 2.CH2.CN + 4Н 2 О = 2NH 3 + НО 2 С.СН 2.СН 2.СО 2 Н; и эта реакция, надо думать, не протекает без перегруппировок; так напр. только что указанный двунитрил может быть получен при действии KCN на хлористый этилиден: CH 3.CHCl2 + 2KCN?2KCl + NC.СН 2.СH 2.CN, т. е. на такое производное, у которого атомы галоида находятся у одного атома углерода (Simpson, Erlenmeyer; ср. Этилен, строение); действие KCN на гомологи хлористого этилидена не изучено систематически; 7) действие α-моногалоидозамещенных эфиров предельных одноосновных кислот на мононатрзамещенные малоновые эфиры, сопровождаемое омылением полученных эфиров и разрушением нагреванием трикарбоновых кислот (см. Трикарболовые и Четырехосновные кисл.): 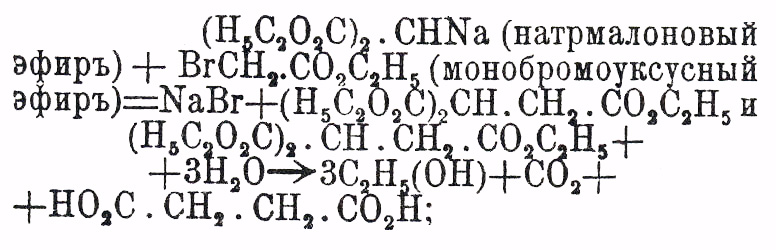
8) разрушение нагреванием соответственных трикарбоновых кислот (l. с.) или четырехосновных (двумалоновых) кислот: 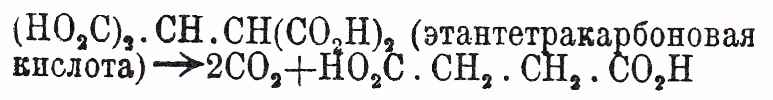 0действие едких щелочей на продукты взаимодействия натрацетоуксусного эфира с α моногалоидозамещенными эфирами предельных одноосновных кислот:
0действие едких щелочей на продукты взаимодействия натрацетоуксусного эфира с α моногалоидозамещенными эфирами предельных одноосновных кислот: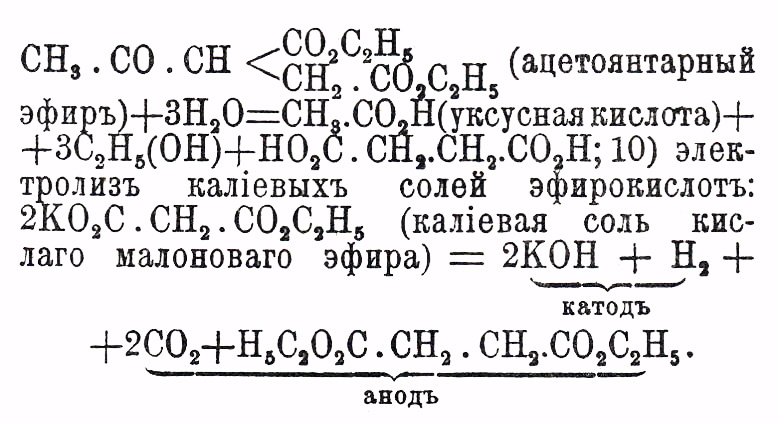
Между реакциями образования Я. кислоты и ее гомологов необходимо упомянуть реакции окисления различных органических веществ; так напр. Я. кислота образуется при окислении (преимущественно азотной кислотой): бутиролактона (см.) и жиров (высших жирных кислот, см.); кислота изопропилянтарная —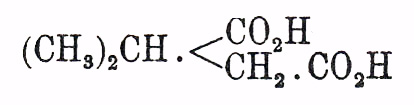
получена при окислении (марганцевокалиевой солью) тетрагидрокарбона (см.) и т. п.; реакции эти не систематизированы и потому являются пока единичными; к единичным же случаям образования относится и появление напр. Я. кислоты при некоторых реакциях брожения (см. ниже). Число известных в настоящее время Я. кислот и их производных громадно: достаточно для пояснения этого обстоятельства заметить, например, что уже любая однозамещенная Я. кислота общей формулы HO 2C. СНR,. СH 2.CO2 H (где R=C NH2N+1), содержа один асимметричный атом углерода, напечатанный курсивом, возможна уже в трех формах: двух оптически деятельных (право- и левовращающих, см. Винная кислота, Молочная кислота, Стереоизомерия, Стереохимия) и их рацемическом (и псевдорацемических (?), см.) полимере; в симметрично двузамещенных Я. кисл. общей формулы НО 2 С.СНХ.СНУ.СО 2 Н имеются два асимметричных атома углерода (напечатаны курсивом), а потому число возможных форм еще больше, усложняясь при тождестве Х и Y (X и Y одноатомные остатки предельных углеводородов) появлением кислот мезо (анти; ср. Винная кислота) типа. Впрочем, далеко не все теоретически возможные формы известны в настоящее время. О номенклатуре Я. кислот см. соотв. ст. В настоящей статье приходится ограничиться более подробным описанием самой Я. кислоты и указанием некоторых наиболее замечательных реакций образования ее гомологов и некоторыми свойствами последних. Я. кислота — НО 2 С.CH 2.СН 2.СО 2 Н = С 4 Н 6 О 4 известна еще Агриколе, как находящаяся в янтаре (Berzelius, Liebig и W ö hler, D'Arcet); она встречается в скипидаре различного происхождения, в соке чистотела (Chelidonium majus; Wolz, Zwenger), чечевицы (K ö hnke), мака (Papaver somniferum), неспелого винограда (Bremmer, Brandenburg), свеклы (v. Lippmann), ревеня (Brunner); в животных организмах она найдена в зобной железе теленка, в щитовидной железе и селезенке быка (Gorup — Besanez), в некоторых патологических эксудатах (Heintz, Brieger), в моче кроликов, кормимых морковью (Meissner и Jolly; ср. Salkowski) и людей, после спаржи (Hilger). Я. кислота получена при окислении азотной кислотою: стеариновой кислоты (Bromeis), японского (Sthamer) и пчелиного (Ronalds) воска, спермацета (Radcliff); кислот: себациновой, азелаиновой (Аrрре), масляной (Dessaignes; из последней она получена и при действии воды и брома (?) при 210°, Friedel, Machuca); при плавлении с едкими щелочами: гуммиарабика, молочного сахара, карминовой кислоты (Hlasiwetz, Grabowski); образование Я. кислоты наблюдено: при спиртовом брожении глюкозы (Pasteur), при брожении (под влиянием дрожжей) аспарагина (см.; Piria), яблочнокислого кальция (см. Яблочная кисл., Dessaignes, Liebig), виннокислого аммония (K öni g); при действии Bacillus lactis aerogenes на яблочную кислоту (Emmerling); при гниении мяса (Е. и H. Salkowski), печени (Ekunia), из фибрина под влиянием стрептококков (Emmerling; ср. кроме того Fitz). Других синтетических реакций ее образования можно и не перечислять, так как они все уже приведены выше при перечислении реакций образования Я. кислот (Schmitt, Dessaignes, Kekul é, Simpson, Wichelhaus, Bandrowski, Бишоф, Steiner, Walker и Brown). Для добывания Я. кислоты прибегают или к перегонке янтаря (acidum succinicum officinale), или же к брожению виннокислого аммония (K ö nig). Я. кислота кристаллизуется в одноклиномерных призмах или пластинках; имеет слабокислый, неприятный вкус; плавится при 185° (Давыдова); при 760 мм. давления кипит, распадаясь на воду и ангидрид, при 235°; образования CO 2 при этом не наблюдено; распадение на СО 2 и пропионовую кислоту: HO 2C.C2H4.СО 2 Н = СО 2 + СН 3.СH 2.СО 2 H, идет, однако, при действии солнечного света на водный раствор Я. кисл. в присутствии солей окиси урана (Seekamp); ср. Предельные органические кисл., реакцию May. Я. кисл. не изменяется под влиянием HNO 3, СrО 3 или хлорной воды; МnО 2 с Н 2 SО 4 дают уксусную кислоту; при плавлении с КОН наблюдается щавелевая кисл. Пятихлористый фосфор последовательно (Kauder) образует с Я. кисл.: ангидрид С 2H4.С 2 О 3 и хлористый сукцинил (несимметричный, иначе двухлоробутиролактон —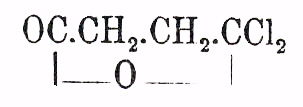
(Gerhardt, Chiozza; Mö ller, Auger; cp,однако D. Vorl ä nder, "Berl. Ber.", 30, 2268 примеч. [1897], о возможности для него симметричной формулы, т. e.C lOC.CH2.CH2.COCl); при одновременном действии пятихлористого фосфора и хлора образуются еще: хлористый фумарил (и хлорангидрид малеиновой кислоты) и, в конце концов, гексахлорэтан — Сl 3 С.ССl 3 (Kauder). О случаях образования ангидрида Я. кисл. упомянуто выше; для добывания его удобно недолговременное кипячение Я. кислоты с хлористым ацетилом (A ü schutz; об изменении ангидрида при долговременном нагревании см. Volhard); это кристаллическое вещество, плав. при 120°, кипящее с некоторым разложением (выделение CO 2 и образование дилактона ацетодиуксусной кисл. — СО(СН 2.СН 2.СО 2 Н) 2, Volhard) при 261°; обладает особым слабым, действующим раздражающим образом на слизистые оболочки носа, запахом; в отличие от кислоты легко растворим в хлороформе; при лежании во влажном воздухе притягивает воду, превращаясь в кислоту; легче идет реакция при кипячении с водой; со спиртами дает соответственные сложные эфиры, с аммиаком и первичными жирными аминами — соответственные аминокислоты, с анилином (толуидином и т. д.) — анилокислоту (см. выше); анилокислоты легко кристаллизуются и служат для характеристики Я. кислоты. При нагревании аминокислоты и анилокислоты теряют элементы воды, превращаясь в имиды (замещенные имиды). Сукцинимид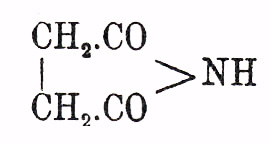
плавится при 126° и кипит при 288°; кристаллизуется с 1H 2 O и является слабой кислотой, способной замещать имидный водород металлами. Многочисленные галоидные производные Я. кисл. получены главным образом не из самой Я. кислоты, а из яблочной и винной кислот замещением их спиртовых, водных остатков галоидами, или же присоединением галоидоводородов, галоидов к малеиновой и фумаровой кислотам; возможны и известны в многочисленных видоизменениях, так как моногалоидоянтарная кислота НО 2 С.СНХ.СН 2 СО 2 Н содержит один асимметричный углеродный атом, а в симметричнодвузамещенных кислотах общей формулы НО 2 С.СНХ.СНХ.СО 2 Н — их два. О продуктах взаимодействия Я. кисл. с альдегидами и кетонами см. Параконовые кисл. Из гомологов Я. кисл. укажем на пировинную кис. НО 2 С.СH(СH 3).СН 2.СО 2 Н и пимелинов. кис. НО 2 С.СН[СН(СН 3)2 ].СН 2.СО 2 Н (см.). Первая, содержа один асимметричный атом С, известна в трех видоизменениях (ср. выше); из них давно открыта рацемическая пировинная кисл. (пара-кислота, см. Винная кислота), образующаяся при сухой перегонке винной кисл. (Fourcroy и Vanquelin) или при действии на них концентрированного НСl при 180° (Genther, Riemann); она же образуется из пировиноградной при нагревании ее до 170° или действии НСl при 100° (B ö ttinger). Реакция, по-видимому, идет таким обр., что из винной (виноградной кисл.) с потерей элементов воды и СО 2 образуется оксиакриловая кисл., превращающаяся в момент образования в пировиноградную кисл.: НО 2 С.СH(OН).СН(ОН)CO 2 H → Н 2 O + СО 2 + СН 2:С(ОН).СО 2 Н (оксиакриловая кис.) → Н 2 О + CO 2 + CH3.CO.CO2 H (пировиноградная кис.), а последняя конденсируется в кетовалерокарбоновую кисл.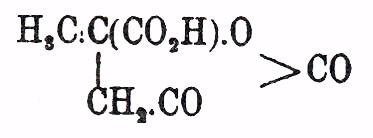
(L. A. 317), которая теряет СО 2, и, присоединяя воду, образует, наконец, пировинную кисл: 2СН 3.СО.СО 2 Н-СО 2 = НО 2 С.СН(СН 3).СН 3.СО 2 Н. О других возможных синтетических случаях образования пировинной кисл. см. выше. Рацемическая пировинная кислота кристаллизуется в трехклиномерных призмах, плавящихся при 112°. При нагревании легко дает ангидрид, плав. при 32° и кип. при 247°. При кристаллизации кислой соли стрихнина удается разделить рацемическую кислоту на правую и левую пировинные кислоты (Ladenburg). Многочисленные галоидозамещенные производные пировинной кислоты получены присоединением галоидоводородов (НСl, НВr) и галоидов к ита-, мезо-, цитраконовым кислотам (см. Цитраконовая кислота). Симметричные двузамещенные Я. кислоты образуются: 1) при гидрогенизации ангидридов двузамещенных малеиновых кислот HJ, или амальгамой натрия (Otto и Beckurts, Bischoff и Voit); 2) из моногалоидозамещенных одноосновных предельных кислот при действии серебра (H e ll и Rothberg), или из тех же галоидозамещенных производных с помощью KCN и C nH2n+1 J (см. выше; Н. Зелинский); 3) из соответственных производных ацетоуксусного эфира (см. выше 9-ую общую реакцию образования Я. кислот), и 4) из соответственных трикарбоновых (малонкарбоновых) кислот при нагревании с крепкой соляной кисл. (Bischoff). Полученную смесь изомеров делят кристаллизацией из воды. Все эти кислоты известны в двух видоизменениях: пара- и антикислотах, природа которых еще не разъяснена. Симм. диметилянтарная кис. НО 2 С.СH(СН 3)СН(CН 3).СО 2 Н — пара-, плав. при 192—194°; при долговременном нагревании распадается отчасти с образованием смеси ангидридов пара- и антикислот; антикислота плав. при 120—123°; при нагревании с соляной кислотой при 190° превращается в паракислоту; другие гомологи отличаются только темпер. плавления и растворимостью, но их взаимные отношения те же. Неизвестно, имеются ли тут случаи монотропии или энантиотропии (ср. Фосфор и Фумаровая кислота).
А. И. Горбов.
| "БРОКГАУЗ И ЕФРОН" >> "Я" >> "ЯН" >> "ЯНТ" |
Статья про "Янтарная кислота и ее гомологи" в словаре Брокгауза и Ефрона была прочитана 2415 раз
| Коптим скумбрию в коробке |
| Семга на горелке |
TOP 15
- Волос
- Проно
- Степные животные
- Гимнастика
- Индийский океан
- Архитектура
- Сравнение, в литературе
- Манда
- Клитры
- Колесование
- Испарение
- Травоядные животные
- Оплодотворение у pacтений
- Вредные насекомые
- Электризация тел