


БНБ
"БРОКГАУЗ И ЕФРОН" (121188)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Эфиры сложные
Определение "Эфиры сложные" в словаре Брокгауза и Ефрона
Эфиры сложные (хим.) — представляют собой сочетания спиртов с кислотами, происходящие путем выделения воды за счет водных остатков этих соединений. Названия [В немецкой химической литературе сложные Э. весьма целесообразно названы, по предложению Гмелина, особым термином "Ester", в отличие от "Aether", т. е. простых Э. По-русски такой разницы в названиях, к сожалению, нет.] их составляются из названий кислотного и спиртового остатка с прибавлением слова "Э.", например уксусно-этиловый Э., азотисто-амиловый Э. и т. п. С увеличением атомности спиртов и основности кислот число возможных форм Э. значительно возрастает. Среди них нужно различать: 1) полные и неполные Э. и 2) средние Э. и эфирокислоты — в зависимости от того, все или не все гидроксилы многоатомного спирта или многоосновной кислоты обменяли свой водород на соответствующий остаток. Среди неполных Э. различают еще первые, вторые и т. д. — по числу заключающихся в них кислотных остатков, например СН 2 (ОН).CH 2.O(СН 3.СО) — первый уксусный Э. этиленгликоля. Названия эфирокислот составляются из названий спиртового остатка и взятой кислоты, например ОН.SO 2.О.С 2H5 — этилсерная кислота. Сложные Э. органических кислот принадлежат к числу соединений, чрезвычайно широко распространенных в природе. Они входят в состав так называемых эфирных масел, вырабатываемых растениями, различных сортов воска, спермацета, различных жиров и жирных масел. Многие из них, обладая приятным фруктовым запахом, находят себе применение в парфюмерии и потому приготовляются искусственно. Таковы, например, уксусноизоамиловый Э. СН 3.CO.O.С 5 Н 11 (запах груши), масляно-этиловый Э. C 3H7.CO.O.C2H5 (запах ананаса), изовалериановоизоамиловый Э. С 4H9.CO. O.С 5 Н 11 (запах яблока) и многие др. Наконец, отдельные представители сложных Э., равно как природные их смеси (например, различные масла), употребляются в медицине и фармации, а азотные Э. глицерина и клетчатки — в минном и артиллерийском деле. Относящиеся сюда подробности приведены в отдельных статьях Словаря, см.: Эфирные масла, Воск, Спермацет, Жиры (хим.). Простейший способ получения сложных Э. состоит в непосредственном действии кислот на спирты, например:
СН 3.СООН + C 2H5.ОН ↔ СН 3 СО.О.С 2H5 + Н 2 О;
NO2.OH + C2H5.OH ↔ NO2.О.C 2H5 + H2O.
Подробности, касающиеся физико-химической стороны этой обратимой реакции, см. в статье Этерификация. Чтобы увеличить выход Э., одно из действующих веществ берут в значительном избытке против другого, а чтобы повысить скорость реакции, прибегают к катализаторам — сухому хлористому водороду или крепкой серной кислоте. Последний прием имеет место при получении этим способом Э. органических кислот. Выбор катализатора обыкновенно определяется свойствами Э., который желают приготовить. Для получения летучих Э. смесь органической кислоты (или ее соли), спирта и серной кислоты перегоняют, причем образующийся Э. собирается в перегон. Его промывают водой, раствором соды, сушат и фракционируют. По Марковникову, в данном случае мы имеем повторение разобранного Вильямсоном процесса образования простых Э., т. е. в первую фазу реакции серная кислота и спирт образуют воду и эфирсерную кислоту, которая далее вступает во взаимодействие с присутствующей органической кислотой, образуя воду и сложный Э., например:
1) OH.SO2.OH + C2H5.OH = OH.SO2.O.C2H5 + H2O;
2)ОН.SO 2.О.С 2 Н 5 + СН 3.СООН = СH 3.СО.О.С 2H5 + ОН.SO 2.ОН.
Для получения нелетучих Э. в качестве катализатора употребляют хлористый водород, который пропускают в смесь кислоты и спирта. По Э. Фишеру, нет надобности продолжать эту операцию до насыщения: в большинстве случаев достаточно ввести несколько (около 3-х) процентов хлористого водорода. Оставив приготовленную таким образом смесь на сутки в теплом месте, ее выливают в воду и обычными приемами отделяют образовавшийся Э. К чему сводится в данном случае действие хлористого водорода — до сих пор представляет открытый вопрос. Фелинг, Фридель, Энгельгардт и Лачинов, Анри допускали здесь образование различных промежуточных продуктов вроде хлорюров, хлорангидридов, ортоэфиров. Но все эти предположения не имеют достаточных экспериментальных оснований: либо гипотетические промежуточные продукты не образуются в условиях опыта, либо они вовсе неизвестны. Другие авторы сводят влияние минеральных кислот вообще к каталитическому действию их водородных ионов, которые, в силу существующих условий равновесия между ними и гидроксильными ионами, способствуют образованию недиссоциированных молекул воды, отчего существенно зависит ход процесса этерификации. Очевидно, такое же действие должны оказывать и сами органические кислоты, участвующие в реакции (автокатализ), но в значительно меньшей степени, так как они чрезвычайно мало диссоциированы, особенно в спиртовых растворах. Другой способ получения Э. органических кислот состоит в действии их ангидридов на спирты в запаянной трубке при 100°. Если действует одна частица ангидрида на две частицы спирта, реакция выражается равенством:
(СН 3.CO)2 O + 2OH.С 2 Н 5 = 2СН 3.CO.O.С 2 Н 5 + Н 2 О.
Выделение воды делает реакцию обратимой. Если же брать оба вещества в эквимолекулярных количествах, реакция полная:
(СН) 3.СО 2 О + OH.С 2H5 = СН 3.CO.O.С 2 Н 5 + СН 3.СООН.
На практике берут избыток ангидрида и, после нагревания со спиртом в течение нескольких часов, выливают смесь в холодную воду и отделяют всплывающий слой Э. Подобным же образом, т. е. без образования воды, идет реакция при действии хлорангидридов кислот на спирты (Жерар), например:
СН 3.СОСl + OH.С 2 Н 5 = СН 3.CO.O.С 2H5 + HCl.
Взаимодействие происходит уже при обыкновенной температуре с выделением значительного количества тепла (+ 19,3 К. для вышеприведенного равенства). Видоизменение этой реакции, известное под названием метода Баумана-Шоттена, особенно часто употребляется для получения сложных Э. ароматических кислот, в частности для бензоилирования многоатомных спиртов и углеводов. Взбалтывая смесь спирта, хлористого бензоила и раствора едкой щелочи до исчезновения запаха хлорангидрида, можно получить продукты полного замещения всех водных остатков бензоилом. Принятое для сложных Э. строение вытекает из реакции их образования при действии серебряных солей кислот на йодюры (Вюрц), например:
C2H5 I + СН 3.COOAg = С 2H5.О.СО.СH 3 + AgI.
Реакцию ведут в запаянной трубке при нагревании. Это один из наиболее общих способов. Малоупотребительное видоизменение его состоит в том, что вместо серебряной соли берут щелочную, а спирт заменяют такой же солью соответствующей эфирсерной кислоты (Пелуз). Смесь солей подвергают сухой перегонке:
СН 3.COONa + NaO.SO2.О.C 2H5 = СН 3.CO.O.С 2H5 + Na2SO4.
Эта реакция, как и предыдущая, позволяет получать легко разлагаемые водой Э. Описанные способы применимы как для получения Э. органических кислот, так и для неорганических. Нужно, однако, заметить, что природа и строение действующих веществ существенным образом влияют на ход отдельных реакций, делая их в некоторых случаях совершенно неприменимыми. Это особенно резко сказывается в инертности диортозамещенных ароматических кислот по отношению к спиртам в присутствии хлористого водорода, тогда как те же самые кислоты легко образуют Э. при взаимодействии их серебряных солей с йодюрами (см. Этерификация).
Свойства. Сложные Э. низших и средних рядов представляют собой прозрачные, бесцветные жидкости, кипящие без разложения. Почти все они (особенно в рядах органических кислот) обладают приятным запахом, зачастую сходным с ароматом цветов и фруктов. Низшие члены очень мало растворимы в воде, все легко растворяются в спирте и Э. Высшие Э. являются твердыми, кристаллическими веществами. Эфирокислоты, в противоположность средним Э., обыкновенно не имеют запаха, гораздо менее прочны (не перегоняются без разложения, скорее обмыливаются) и, как все соединения, заключающие гидроксильные группы, способны растворяться в воде. Физические свойства сложных Э. прекрасно исследованы. Ниже приведены в таблицах температуры кипения и удельные веса Э. жирных кислот нормального строения, взятые из работы Гартенмейстера. Таблицы составлены так, что в них данные, относящиеся к метамерным Э., расположены по диагоналям, идущим слева и снизу направо и вверх.
I. Температуры кипения при 760 мм.
| Кислоты | Спирты | |||||||
| Метил. | Этил. | Пропил. | Бутил. | Амил. | Гексил. | Гептил. | Октил. | |
| Муравьиная | 32,5 | 55,0 | 81,0 | 106,9 | 130,4 | 153,6 | 176,7 | 198,1 |
| Уксусная | 57,3 | 77,5 | 101,8 | 124,5 | 147,6 | 169,2 | 191,3 | 210,0 |
| Пропионовая | 79,5 | 98,8 | 122,6 | 145,4 | — | — | 208,0 | 226,4 |
| Масляная | 102,3 | 120,9 | 143,2 | 165,7 | 184,8 | 205,1 | 225,2 | 242,2 |
| Валериановая | 127,3 | 144,7 | 167,5 | 185,8 | 203,7 | 223,8 | 243,6 | 260,2 |
| Капроновая | 149,6 | 166,6 | 185,5 | 204,3 | — | — | 259,4 | 275,2 |
| Гептиловая | 172,1 | 181,1 | 206,4 | 225,1 | — | — | 274,6 | 290,4 |
| Октиловая | 192,9 | 205,8 | 224,7 | 240,5 | — | — | 289,8 | 305,9 |
II. Удельные веса при 0°.
| Кислоты | Спирты | |||||||
| Метил. | Этил. | Пропил. | Бутил. | Амил. | Гексил. | Гептил. | Октил. | |
| Муравьиная | 1,0009 | 0,9445 | 0,9250 | 0,9108 | 0,9018 | 0,8977 | 0,8937 | 0,8929 |
| Уксусная | 0,9643 | 0,9253 | 0,9093 | 0,9016 | 0,8945 | 0,8902 | 0,8891 | 0,8847 |
| Пропионовая | 0,9403 | 0,9114 | 0,9023 | 0,8953 | — | — | 0,8846 | 0,8833 |
| Масляная | 0,9194 | 0,9004 | 0,8929 | 0,8878 | 0,8832 | 0,8825 | 0,8827 | 0,8794 |
| Валериановая | 0,9097 | 0,8939 | 0,8888 | 0,8847 | 0,8812 | 0,8797 | 0,8786 | 0,8784 |
| Капроновая | 0,9039 | 0,8888 | 0,8844 | 0,8824 | — | — | 0,8769 | 0,8748 |
| Гептиловая | 0,8981 | 0,8861 | 0,8824 | 0,8807 | — | — | 0,8761 | 0,8757 |
| Октиловая | 0,8942 | 0,8842 | 0,8805 | 0,8797 | — | — | 0,8754 | 0,8755 |
Здесь, как и при простых Э., влияние метамерии сказывается в том, что в ряду метамеров температура кипения понижается с приближением кислородного атома к середине цепи. Исключением является пропионовопропиловый Э., кипящий при 122,6°, тогда как масляно-этиловый кипит при 120,9°. Параллельно изменению температур кипения изменяются и удельные веса; среди метамеров наибольшей плотностью обладают наиболее высоко кипящие Э. Из химических свойств сложных Э. наиболее характерна для них способность к омылению, т. е. к обратному присоединению элементов воды с образованием спирта и кислоты, например:
СН 3.CO.O.C2H5 + Н 2 О = СН 3.СООН + C 2H5.ОН.
Чистая вода, хотя бы взятая в большом избытке, обмыливает Э. сравнительно очень медленно, особенно низшие. Скорость реакции значительно повышается, если к воде прибавить сильной минеральной кислоты (HCl, H 2SO4) или щелочи. Здесь, следовательно, прибавка кислоты действует в направлении, как раз обратном тому, какое было указано выше, при рассмотрении реакций образования Э. Омыление Э. было чрезвычайно полно исследовано с точки зрения закона действующих масс и теории электролитической диссоциации. В этом направлении работали: Вардер, Ван-Гофф, Рейхер, Оствальд, Аррениус, Шпор и др. Действие разведенных щелочей на Э. протекает согласно равенству:
СН 3.CO.O.С 2 Н 5 + NaOH = CH3.СО.ONa + С 2H5.ОН
и представляет собой необратимую двумолекулярную реакцию, скорость которой определяется по количеству x превращенного вещества во время t при концентрациях Э. и щелочи равных a и b, следующим уравнением:
dx/dt = k(a — x)(b — x),
откуда, при условии, что x = 0, когда t = 0:
k = 1/[t(a — b)] ln [(a — x)b]/[(b — x)a].
Если Э. и щелочь взяты в эквивалентных количествах (a = b), вышеприведенное уравнение скорости представляется в виде:
dx/dt = k(a — x)2,
откуда, при том же условии:
k = x/[t(a — x)a].
Множитель k представляет собой константу, зависящую, при прочих равных условиях, от химической природы действующих веществ. Исследования Рейхера и в особенности Оствальда показали, что величина k почти одинакова для сильных оснований. Так Рейхер, обмыливая уксусно-метиловый Э. различными основаниями при 9,4°, получил для k следующие значения:
| k | k | ||
| NaOH | 2,307 | KOH | 2,298 |
| Ca(ОН) 2 | 2,285 | Sr(ОН) 2 | 2,204 |
| Ba(ОН) 2 | 2,144 | NH4OH | 0,011 |
Оствальд, дополнив данные Рейхера, указал на существование тесного параллелизма между этими динамическими константами и константами электропроводности, сопоставив их в следующей таблице:
| Константы | ||
| динамические: | электрические: | |
| KOH | 161,0 | 161,0 |
| NaOH | 162,0 | 149,0 |
| LiOH | 165,0 | 142,0 |
| Tl(OH)3 | 158,0 | 156,0 |
| NH4OH | 3,0 | 4,8 |
| (CH3)NH2 | 19,0 | 20,2 |
| (C2H5)NH2 | 19,0 | 20,5 |
| (C3H7)NH2 | 18,6 | 18,4 |
| iso (C4H9)NH2 | 14,4 | 15,2 |
| (C3H11)NH2 | 18,5 | 18,6 |
| (C3H5)NH2 | 4,0 | 6,9 |
| (СН 3)2 NН 2 | 22,0 | 23,5 |
| (С 2H5)2 NН 2 | 26,0 | 28,3 |
| (СН 3)5 NН 2 | 7,3 | 97,0 |
| (C2H5)3NH2 | 22,0 | 20,2 |
| пиперидин | 27,0 | 27,0 |
| (C2H5)4N.OH | 131,0 | 128,0 |
В той же работе Оствальд указывает на непостоянство "постоянной" k при омылении слабыми основаниями, например аммиаком, для которого получаются следующие цифры:
| t | k | |
| 0° | — | — |
| 60° | 1,640 | 1,760 |
| 160° | 1,170 | 1,210 |
| 240° | 1,040 | 1,010 |
| 420° | 0,817 | 0,845 |
| 1470° | 0,484 | 0,501 |
Как показали опыты Аррениуса, такое уменьшение константы скорости зависит от образования соли во время реакции (в данном случае уксусно-аммониевой). То же самое, очевидно, имеет место и при омылении сильными основаниями, например едким натром, но здесь влияние образующейся натриевой соли на величину константы ничтожно. Все эти факты получают прекрасное объяснение с точки зрения теории электролитической диссоциации, если представить себе омыление, например, уксусно-этилового Э. едким натром, как реакцию гидроксильных ионов щелочи:
CH3.CO.O.C2H5 + OH— + Na+ = CH3.CO—.O=Na + C2H5OH.
Тогда становится понятным, почему положительная часть сильных оснований (металл) не оказывает влияния на скорость реакции и почему существует параллелизм между динамическими и электрическими коэффициентами сродства. Дело в том, что величина константы электропроводности зависит от степени диссоциации данного основания, т. е. от количества гидроксильных ионов в растворе. Таким образом, у сильных оснований, которые приблизительно одинаково диссоциированы, число гидроксильных ионов в растворе должно быть одинаково, а следовательно, одинакова должна быть и скорость производимого ими омыления. Сообразно с только что сказанным, вышеприведенное уравнение скорости для двухмолекульных реакций примет вид:
dx/dt = k' α (a—x)(b—x),
где α — степень диссоциации основания. Из теории электролитической диссоциации следует, что величина α может изменяться от присутствия в растворе других электролитов с одноименными ионами. В данном случае такими электролитами будут средние соли, образующиеся при омылении, у которых катионы общие со щелочами. Если основание так же диссоциировано, как его соль, то при данной концентрации их смеси степень диссоциации основания не зависит от количества соли в растворе. В этом случае последнее уравнение опять примет первоначальный вид, так как k' α за все время опыта будет оставаться постоянным, равным k. Иное дело, если основание диссоциировано слабо, а соль его сильно, каковы, например, растворы аммиака и аммониевых солей. Тогда, в силу существующего соотношения между диссоциированной и недиссоциированной частью электролита, c'c" = kc (c' и c" — концентрации ионов, c — концентрация недиссоциированной части, k — константа электропроводности), образование большого числа ионов NH' 4 должно сильно понижать и без того слабую диссоциацию аммиака: произведение k' α должно с течением времени уменьшаться, как это и есть на самом деле. Подобно щелочам, омыление Э. производится и разведенными минеральными кислотами. Исследования Оствальда показали, что и здесь дело сводится к действию водородных ионов минеральной кислоты, числу которых (в первом приближении) пропорциональна константа скорости этой реакции. Если, однако, сравнивать цифры, полученные при омылении различных Э. основаниями и кислотами, между ними замечается некоторая разница, заставляющая предполагать, что гидроксильные ионы щелочи и водородные ионы кислоты действуют на частицу Э. различным образом. При омылении основаниями Э. различных спиртов величины констант изменяются приблизительно в том же смысле, как и при этерификации этих спиртов, тогда как при омылении кислотами этого не замечается. Если же, наоборот, взять Э. разных кислот и одного спирта, замечаются обратные отношения, т. е. влияние природы кислоты довольно резко сказывается при омылении кислотами и гораздо меньше при омылении основаниями (Рейхер, Де-Гемптин, Левенгерц). Эти данные заставляют предполагать, что при омылении щелочью действие гидроксильных ионов направляется между спиртовым радикалом и кислородом, т. е. возникает связь между спиртовым радикалом и гидроксилом, а отрицательный заряд гидроксила переносится на кислотный анион, например: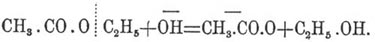
При омылении кислотами действие водородных ионов направлено между кислотным радикалом и кислородом, причем положительный заряд переносится на кислотный остаток, например: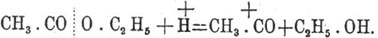
Гипотетический кислотный остаток с водой вновь образует водородный ион:
(CH3CO)+ + H2O = CH3COOH + H+.
Сложные Э., подобно простым, нацело распадаются при действии на них галоидоводородных кислот, причем образуется свободная кислота и галоидный алкил, например:
СН 3 СО.О.C 2H5 + HI = CH3.COOH + C2H5I.
Такое распадение совершается тем легче, чем больше молекулярный вес галоидоводорода: энергичнее всего действует йодистый водород (Заппер). Крепкие водные растворы аммиака медленно растворяют сложные Э., которые при этом распадаются с образованием амидов кислот, например:
CH3.CO.O.C2H5 + NH3 = CH3.CО.NH 2 + C2H5.ОН (Дюма).
Заключая карбонильный кислород, сложные Э. способны к образованию сложных комплексов при взаимодействии с металлоорганическими соединениями цинка (Зайцев и Вагнер) и магния (Гриньяр, Массон), которые при разложении водой дают спирты. Особенно легко и удобно идет реакция с магнийорганическими соединениями. Э. муравьиной кислоты применяются для получения вторичных спиртов, прочие Э. с магнийорганическими соединениями дают третичные спирты, например: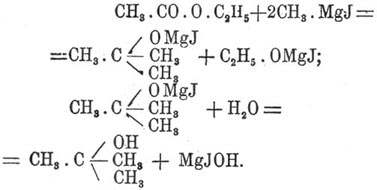
В химической практике сложные Э. имеют большое значение для характеристики спиртов и кислот. Будучи соединениями в большинстве случаев летучими и сравнительно легко получаемыми, они дают возможность определять основность кислот по числу вошедших спиртовых остатков, равно как атомность спиртов по числу кислотных остатков.
Ниже приведены свойства главнейших представителей сложных Э. неорганических кислот. Э. галоидоводородных кислот являются в то же время галоидозамещенными углеводородами, где они и описаны (см. Хлоропарафины, Хлороолефины). По своим свойствам эти вещества находят себе обширное, применение в химической практике. Э. кислородных кислот хлора известны хлорноватистые и хлорные. Легко разлагающиеся, взрывчатые жидкости. Хлорноватисто-метиловый Э. (СН 3.О.Cl), температура кипения 12° при 726 мм. Хлорно-этиловый Э. (C 2H5.О.СlO 3), температура кипения 74°. Э. азотистой кислоты, изомерные с нитропроизводными углеводородов, получаются вместе с ними при действии йодистых алкилов на азотисто-серебряную соль (В. Мейер). Для получения азотистых Э. в чистом виде разведенный водный раствор азотисто-натриевой соли смешивают с небольшим избытком спирта и разлагают серной кислотой на холоде. При перегонке азотистых Э. глицерина с одно- или двухатомными спиртами также получаются азотистые Э. этих последних, например:
2С 2H5(O.NO)3 + 3С 2H4 (ОН) 2 = 3C2H4(O.NO)2 + 2C3H5(OH)3.
Жидкости с приятным запахом, кипящие значительно ниже изомерных с ними нитросоединений. Метиловый Э. (СН 3 О.NO), температура кипения 12°; этиловый Э. (C2H5.О.NO), температура кипения 17°. Э. азотной кислоты получаются при действии крепкой азотной кислоты на спирты в присутствии мочевины, которая разрушает образующуюся во время реакции азотистую кислоту:
CO(NH2)2 + 2НNO 2 = 3Н 2 О + СО 2 + 2N2.
Без этой предосторожности получаются, главным образом, азотистые Э. — приятно пахнущие жидкости, кипящие выше соответствующих азотистых Э. Зажженные, горят белым пламенем, нагретые выше температуры кипения, сильно взрывают. При восстановлении цинком и соляной кислотой дают гидроксиламин:
С 2H5 О.NО 2 + 3Н 2 = С 2H5.OH + OH.NН 2 + Н 2 О.
Метиловый Э. (CH 3.O.NO2), температура кипения 65°, удельный вес 1,2322 при 0°; этиловый Э. (С 2H5.О.NO 2), температура кипения 87°, удельный вес 1,1322 при 0°. Из азотных Э. многоатомных спиртов громадное применение имеет нитроглицерин (см.). Из Э. многоосновных неорганических кислот важное значение имеют Э. серной кислоты, особенно серно-эфирные кислоты (см.). Средние Э. получаются при нагревании этих последних, например:
2OH.SO2.O.СН 3 = SО 2 (О.СН 3)2 + OН.SO 2.OH,
или по общему способу — при действии галоидных алкилов на серно-серебряную соль. Густые, нерастворимые в воде жидкости, с запахом перечной мяты. Метиловый Э. [(СН 3.O)2S О 2 ], температура кипения 188°, удельный вес 1,3334 при 15°. Этиловый Э. [(C 2H5.O)2SO2 ], температура кипения 208°, удельный вес 1,1837 при 19°. При сильном охлаждении застывает в кристаллы, плавящиеся при —24,5°. Физические свойства низших и средних Э. органических кислот жирного ряда и предельных одноатомных спиртов даны в приведенных выше таблицах. Свойства различных высших Э., входящих в состав воска, жиров, масел и т. п., см. в соответствующих статьях Словаря.
Д. Монастырский. Δ.
| "БРОКГАУЗ И ЕФРОН" >> "Э" >> "ЭФ" |
Статья про "Эфиры сложные" в словаре Брокгауза и Ефрона была прочитана 2328 раз
| Коптим скумбрию в коробке |
| Панайпай |
TOP 15
- Волос
- Проно
- Степные животные
- Гимнастика
- Индийский океан
- Архитектура
- Сравнение, в литературе
- Манда
- Клитры
- Колесование
- Испарение
- Травоядные животные
- Оплодотворение у pacтений
- Вредные насекомые
- Электризация тел