


БНБ
"БРОКГАУЗ И ЕФРОН" (121188)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Этерификация
Определение "Этерификация" в словаре Брокгауза и Ефрона
Этерификация — При действии кислот на алкоголь одновременно происходит 2 реакции: 1) Сначала образование сложного эфира по уравнению: RСО 2 H + R'OН = RСО 2R' + H2 O. 2) Тотчас же разложение эфира водой, образующейся при реакции, по обратному уравнению: RCO 2 R' + Н 2O = RCO2 H + R'ОН. Эта реакция характеризуется следующими явлениями: 1') образование эфира совершается медленно и постепенно. 2') Образование эфира никогда до конца не идет, как бы долго реакция не совершалась. 3') Количество образующегося эфира зависит от условий, при которых совершается опыт. Эта реакция была точно изучена M. Berthelot и P é ant de Saint Gilles'ом. Для примера приведем некоторые из многочисленных, сделанных этими учеными опытов, а именно те, которые доказывают ход процесса. Смесь уксусной кислоты и алкоголя в количествах, соответствующих их молекулярным весам, была оставлена стоять при обыкновенной температуре. Количество кислоты, прореагировавшей со спиртом, оказалось следующим:
| К концу первого дня | 0,9 из 100 частей кислоты |
| К концу 3 дней | 2,7 из 100 частей кислоты |
| К концу 72 дней | 26,0 из 100 частей кислоты |
| К концу 277 дней | 53,7 из 100 частей кислоты |
| К концу 16 лет | 65,0 из 100 частей кислоты |
Из приведенных данных видно, что реакция при обыкновенных условиях идет очень медленно; из ряда других опытов ясно вытекает, что реакция имеет предел, т. е. не идет до конца. Смесь алкоголя и бензойной кислоты, нагретая до 150°, дает следующие количества кислоты, вступившей в реакцию:
| К концу 5 часов | 49,0 из 100 частей кислоты |
| К концу 20 часов | 66,3 из 100 частей кислоты |
| К концу 28 часов | 66,5 из 100 частей кислоты |
| К концу 50 часов | 66,4 из 100 частей кислоты |
Пытались выразить эти явления алгебраической формулой, и сначала Бертело, потом Гульдберг и Ваге и, наконец, Ван-Гоф формулировали связь между количествами кислоты, алкоголя, эфира и воды, находящимися в равновесии в любой определенный момент реакции. В настоящее время общепринята, как подтверждающаяся вполне опытом, формула Ван-Гофа, который выразил эту связь следующим образом: он предположил, что скорость реакции пропорциональна произведению P и Q, обозначающих количество реагирующих молекул спирта и кислоты, и обратно пропорциональна объему v (иначе говоря, пропорциональна концентрации), что выражается формулой:
du/dt = c∙PQ/v.
И если принять за единицу количество молекул кислоты в начале реакции, k — количество молекул алкоголя, q — воды, u — количество молекул эфира, то в данный момент жидкость будет заключать: (1 —u) молекул кислоты; (k—u) молекул алкоголя; u молекул эфира; (q + u) молекул воды.
Скорость образования эфира будет:
du1/dt = c1∙[(1 — u)(k — u)/v];
скорость распадения эфира:
du2/dt = c2∙[u(q + u)/v],
где c1 и c2 постоянные коэффициенты.
Общая же скорость Э. будет:
du/dt = du1/dt — du2/dt = c1∙[(1 — u)(k — u)/v] — c2∙[u(q + u)/v](1)
и предел Э., который соответствует очевидно нулевой скорости, будет найден по уравнению:
du/dt = 0 или c1∙(1 — u)(k — u) = c2∙u(q + u)(2).
Интегрируя уравнение (1) и решая его относительно u, можно узнать количество эфира, образовавшееся в данное время. Решая уравнение (2), найдем предел для определенных пропорций в определенных условиях. Эти числа соответствуют довольно точно числам, найденным Бертело и Пеан де Сент-Жилем. В формуле Ван-Гофа коэффициенты c1 и c2 представляют влияние разных условий на ход и продолжительность реакции. Главные из этих условий следующие: 1) температура, 2) давление, 3) состояние реагирующих веществ (газы, жидкости, свойства растворителя), 4) наконец, специфические свойства реагирующих тел. Из опытов Бертело и Пеан де Сент-Жиля видно, что температура не влияет на предел Э., ибо предел, достигнутый при обыкновенной температуре, через 16 лет почти один и тот же, что при 150° через 20—28 часов, и равен 66. Если это заключение верно, что трудно точно проверить, так как трудно достигнуть идентичности всех остальных условий при высоких температурах и медленности действия при обыкновенной, то значение предела Э., определенное из уравнения c1∙(1—u)(k—u) = с 2∙u(q + u), будет независимо от t°, откуда следует, что c1/c2 есть функция, независимая от t°, иначе сказать, что коэффициент действия алкоголя на кислоту так же зависит от t°, как и коэффициент действия воды на образовавшийся эфир. Давление, как показывает прямой опыт, не оказывает видимого действия ни на скорость, ни на предел Э.; Бертело убедился в этом, нагревая одновременно две трубки с реагировавшими веществами, из которых в одной давление было повышено до 60—80 атмосфер, выход эфира был один и тот же. Объем, который занимает смесь спирта и кислоты, имеет громадное влияние на скорость, особенно при высоких температурах, когда вещества переходят в парообразное состояние. Так, нагревая вещества до 200°, в таких условиях, что в одном случае грамм занимал объем 2,6 куб. см, а в другом 1351 куб. см, Бертело нашел, что в первом случае через 10 часов этерифицировалось 62,5 %, а в другом в то же время только 10 %. Подобным же образом действует растворение в индифферентных растворителях, т. е. с разбавлением скорость Э. падает. Влияние химических свойств кислот и спиртов на предел Э. очень мало, как это видно из следующей таблицы:
| Спирты | Кислоты | Пределы |
| Этиловый | Уксусная | 66,9 |
| " | Масляная | 69,8 |
| " | Валериановая | 67,6 |
| " | Бензойная | 67,0 |
| Метиловый | Уксусная | 67,5 |
| " | Валериановая | 65,9 |
| " | Бензойная | 64,5 |
| Амиловый | Уксусная | 68,9 |
| " | Масляная | 70,7 |
| " | Валериановая | 70,5 |
| " | Бензойная | 70,0 |
| Бензиловый | Уксусная | 63,3 |
| Гликоль | " | 68,8 |
| Глицерин | " | 69,3 |
Если брать для реакции вещества не в молекулярных отношениях, а увеличивать массу одного относительно другого, то предел Э. повышается и стремится при увеличении отношения между массами к 100, следуя вполне закону действия масс. Так, при действии на частицу уксусной кислоты n частицами этилового спирта, получается, считая количество кислоты за 100:
| n | Предел | n | Предел |
| 0,20 | 19,3 | 2,8 | 85,6 |
| 0,45 | 39,0 | 4,0 | 88,2 |
| 0,50 | 42,0 | 5,4 | 90,2 |
| 0,67 | 54,6 | 12,0 | 93,2 |
| 1,00 | 66,6 | 19,0 | 95,0 |
| 1,50 | 77,9 | 50,0 | 100,0 |
| 2,00 | 82,8 |
Вопрос о влиянии строения алкоголей и кислот на скорость и предел Э. хотя и был затронут Бертело и Пеан де Сент-Жилем, но не был решен. Детально разработал его Н. А. Меншуткин, который, основываясь на массе сделанных опытов, пользуясь различием в скоростях и пределе Э., дал метод для определения строения изомерных кислот и алкоголей. Для сравнения различных алкоголей и кислот Н. А. Меншуткин производил все опыты при одной и той же концентрации в бензольном растворе, с количествами, точно соответствующими молекулярным весам алкоголя и кислоты, при нагревании до 155°, в запаянных трубочках, определяя оставшуюся после нагревания свободную кислоту титрованием баритовой водой с розоловой кислотой в качестве индикатора. Для сравнения различных алкоголей Н. А. Меншуткин определил скорости и пределы образования уксуснокислых эфиров (начальной скоростью называется средняя скорость в течение первого часа).
| Алкоголи первичные | Пределы | Начальные скорости |
| Спирт метиловый | 69,60 | 55,60 |
| Спирт этиловый | 66,57 | 46,95 |
| Спирт пропиловый | 66,85 | 46,92 |
| Спирт бутиловый | 67,30 | 46,85 |
| Спирт изобутиловый | 67,38 | 44,36 |
| Спирт октиловый | 72,34 | 46,57 |
| Спирт аллиловый | 59,41 | 35,72 |
| Спирт бензиловый | 60,75 | 38,64 |

Из приведенной таблицы видно, во-первых, что начальными скоростями Э. различные спирты более резко отличаются друг от друга, чем пределами Э. 2) Предельные спирты имеют наивысший предел Э. и наибольшую скорость. 3) Число углеродных атомов в спирте мало влияет на предел и скорость Э. — так, нормальные предельные спирты, если не считать метилового, имеют одинаковые скорости, пределы с возрастанием числа атомов углерода увеличиваются, но очень мало. 4) Наибольшее значение имеет положение гидроксила: первичные спирты имеют наивысший предел и наибольшую скорость, третичные — наименьшую. Те же соотношения замечаются и при действии различных кислот на какой-либо спирт. Н. А. Меншуткин для сравнения кислот между собой пользовался их действием на изобутиловый спирт при тех же условиях, как и при изучении Э. спиртов. Следующая таблица подтверждает сказанное:
| Первичные кислоты | Пределы | Скорость |
| Муравьиная | 64,69 | 61,23 |
| Уксусная | 67,38 | 44,36 |
| Пропионовая | 68,70 | 41,18 |
| Масляная | 69,52 | 33,25 |
| Каприловая | 69,81 | 33,08 |
| Вторичные кислоты | ||
| Изомасляная | 69,41 | 29,03 |
| Метилэтилуксусная | 73,73 | 21,50 |
| Третичные кислоты | ||
| Триметилуксусная | 72,65 | 8,28 |
| Диметилэтилуксусная | 74,00 | 3,45 |
| Бензойная | 72,56 | 8,62 |
| Паратолуиловая | 76,52 | 6,64 |
| Куминовая | 75,91 | 6,24 |
Опыты Н. А. Меншуткина дают возможность, пользуясь реакцией образования сложных эфиров, устанавливать изомерию спиртов и кислот, изучая их скорость и предел. Таковы результаты, полученные при изучении непосредственного действия спиртов и кислот друг на друга. Между другими способами получения сложных эфиров есть один, которым часто пользуются и который дает много данных по изомерии кислот, это именно действие кислот на спирты в присутствии сильных неорганических кислот, особенно соляной, причем предел и скорость значительно повышаются. Для объяснения контактного влияния хлористо-водородной кислоты предлагалось много теорий. Бертело предполагает, что HCl играет просто дегидратирующую роль; Фелинг — что спирты с ней реагируют, образуя хлоргидрины спиртов, Фридель — образование хлорангидридов кислот (оба маловероятные предположения), Анри — образование промежуточных соединений, первых ортоэфиров кислот,

которые или, прямо выделяя воду, дают сложные эфиры или, реагируя сначала с HCl, дают хлоргидрины этого эфира,

которые, выделяя HCl, дают эфир. По господствующей в данное время теории электролитической диссоциации, реакция ускоряется благодаря присутствию свободных водородных ионов, которые способствуют более легкому выделению воды при образовании сложного эфира, что отчасти находит подтверждение и в том, что скорость Э. при обыкновенных условиях, в отсутствии HCl, находится в прямом соотношении с электролитической диссоциацией кислот, константы (c1/c2) их одинаковы. Каково бы ни было объяснение действия HCl на Э., так как реакция и в этих условиях ограничена пределом, то является возможность изучить благодаря большой скорости реакции, допускающей работать при обыкновенной температуре, массу кислот, которые при высоких температурах не могут исследоваться вследствие разложения. Изучение спиртов и кислот жирного ряда при этих условиях ничего нового не дает, и реакция, благодаря высокому пределу, применяется для получения сложных эфиров; изучение же Э. ароматических кислот при контактном действии HCl имело большое значение, что было выяснено особенно работами Виктора Мейра его учеников. Виктор Мейр, работая над этерификацией кислот ароматического ряда, нашел, что некоторые из них дают только очень малые количества эфира при действии газообразной ClH на их раствор в метиловом спирте, в то время как другие в тех же условиях дают более 90 % эфира. Так, раствор бензойной кислоты в метиловом спирте при 0° Ц., подвергаясь действию газообразного хлористого водорода, дает к концу 12 часов 92 % бензойно-метилового эфира, между тем мезитиленкрабоновая, трихлорбензойная и трибромбензойная 1.2.4.6 кислоты в тех же условиях совсем почти не дают эфира. Виктор Мейр изучил большое количество кислот ароматического ряда и заметил, что на Э. имеют сильное влияние группы, находящиеся в ортоположении, что каждый раз, как водород при углероде, находящемся в ортоположении относительно карбоксила, замещался какими-нибудь остатками, как, например, СH 3, Br, Cl, NO2 и проч., образования метиловых эфиров в вышеуказанных условиях не происходило. Это правило, данное Виктором Мейром, применимо и к другим ядрам, кроме бензольного; так, хлорнафтиловая кислота 1.2
не дает эфира, в то время как кислота 1.3
дает 90 % эфира, и кислоты антраценкарбоновые и хлорантраценкарбоновые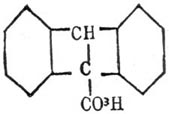
также не дают эфира в этих условиях. На ход Э. имеет громадное влияние то, какие группы находятся в ортоположении. Так, диортокислоты, в которых заместителями служат Cl, Br, I, СО 2H, O2, не дают эфира ни на холоде, ни при нагревании, если же стоят в ортоположении HO, CH 3 и другие углеводородные остатки, то при кипячении образуются эфиры. Так, кислоты:
тимоловая C 6H2CO2 H.ОН.C 3H3CH3 1.2.3.6,
фенилсалициловая C 6H3CO2HC6H5OH 1.2.6,
нафтолкарбоновая C 10H6CO2H.OH 1.2
при 0° Ц. не дают эфира, при кипячении же к концу 12 часов дают 20 % эфира. Правилу Виктора Мейра удовлетворяют вполне большинство многоосновых ароматических кислот. Так, кислота меллитовая
не дает эфира при действии газообразного хлористого водорода на метиловый спирт, а кислота пиромелитовая
дает 90 % эфира, причем алкогольный остаток вступает в соединение с четырьмя карбоксилами; кислота пренитовая
дает двухзамещенный эфир; кислота мелофановая
трехзамещенный, так же как и кислоты тримезиновая, тримелитовая
тогда как кислота гемимелитовая дает только двухзамещенный эфир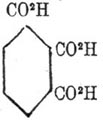
Из приведенных примеров видно, что в многоосновных ароматических кислотах карбоксилы, находящиеся в ортоположении, как бы утрачивают совсем или отчасти способность непосредственно вступать в реакцию со спиртами. Сколько-нибудь удовлетворительного объяснения этого факта не найдено. В. Мейер предполагал, что группы, находящиеся в ортоположении, пространственно препятствуют ходу реакции, чему противоречит то, что серебряные соли диортокислот с йодгидринами спиртов, как и все кислоты, дают сложные эфиры соответствующих спиртов. Наблюденные при Э. соотношения между строением реагирующих соединений, с одной стороны, пределами и скоростями реакций — с другой, повторяются и при других реакциях подобного характера, как, например, при образовании аминов, простых эфиров и проч.
Н. Тутурин.
| "БРОКГАУЗ И ЕФРОН" >> "Э" >> "ЭТ" >> "ЭТЕ" |
Статья про "Этерификация" в словаре Брокгауза и Ефрона была прочитана 2532 раз
| Коптим скумбрию в коробке |
| Семга на горелке |
TOP 15
- Волос
- Проно
- Степные животные
- Гимнастика
- Индийский океан
- Архитектура
- Сравнение, в литературе
- Манда
- Клитры
- Колесование
- Испарение
- Травоядные животные
- Оплодотворение у pacтений
- Вредные насекомые
- Электризация тел