


БНБ
"БРОКГАУЗ И ЕФРОН" (121188)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Химия
Определение "Химия" в словаре Брокгауза и Ефрона
Химия — Первоначальное значение и происхождение этого слова неизвестно; возможно, что оно просто старое название северного Египта, и тогда наука Chemi значит — египетская наука; но так как Chemi, кроме Египта, обозначало еще черный цвет, a μελάνοσις (чернение) считалось операцией, неизбежной при превращениях металлов, то, может быть, что τέχνη τής χημείας — Олимпиодора, есть искусство приготовления этого чернящего вещества (ср. H. Kopp, "Geschichte der Chemie", II, 1844, 4 — 6, и M. Berthelot, "Introduction а l 'é tude de la chimie des anciens et du moyen вge", 1889). "От большинства других наук X. в своем развитии отличается тем, что цель ее понималась различно в разные времена... В то время, как в других областях духовной деятельности, каково бы ни было отношение к ним в иные периоды, всегда ясно сознавалась цель, и она неуклонно имелась в виду, в истории X. этого совершенно не наблюдается. У этой науки меняются не только выбор вспомогательных средств и применений, но и вся задача, и условия ее существования (ср. Алхимия, Иатрохимики, Флогистон)... В настоящее время, — продолжает Г. Копп ("Geschichte der Chemie", I, 1843, 5), задачей X., взятой самой по себе (an und f ü r sich), является разложение соединений на составные части и образование из составных частей снова соединений [Это определение ведет свое начало еще с середины XVII стол., когда Лемери, в своем "Cours de Chymie", говорит, что "La Chymie est un art, qui enseigne а s é parer les differentes substances qui se rencontrent dans un mixte" (Корр. "Geschich.". II, 8), а Сталь прибавлял к этому "и искусство образования снова смесей из составных частей" (Корр, l. с.). Понятие о составных частях смесей менялось; современное намечено уже Бойлем, но общепринято только после Лавуазье (см. Лавуазье и Флогистон).]. Задачей является, следовательно, знание состава всех тел и того именно, как они образованы и как могут быть образованы". Д. И. Менделеев ("Основы X.", 6-е изд., 1895, 2) определяет X., как естественно-историческую науку, ближайшим предметом которой является "изучение однородных веществ, из сложения которых составлены все тела мира, их превращений и явлений, сопровождающих такие превращения". По Оствальду (W. Ostwald, "Grundlinien der anorg. Ch.", 1900, 1), "эти превращения можно разбить на две больших, не совсем строго обособленных группы. Иногда превращения касаются только одного, или же немногих отношений и свойств изучаемого тела; иногда же они таковы, что изучаемое тело исчезает, как таковое, а вместо него являются новые тела с новыми свойствами. Явления первого рода входят в область физики, второго — в область X.", и, как пример, Оствальд рассматривает отношение серы к механическим толчкам (изменяется относительное положение тела, но не меняются: цвет, вес и т. п., так назыв. физические свойства его), к слабому нагреванию (изменяются — температура, удельный вес и объем, давление пара, другие (?) свойства остаются неизмененными), к электризации и находит, что явления такого рода должно считать физическими. Но "если привести (l. с., 2) кусок серы в соприкосновение с огнем, он загорается и горит синим пламенем. При этом чувствуется общеизвестный запах горящей серы, и после того, как горение шло несколько времени, сера, как таковая, исчезает: она сгорела. При этом процессе не только изменяются отдельные свойства серы, но... вместо нее образовалось что-то другое; это мы можем судить по запаху, который появился одновременно с началом явления, а раньше не был заметен. В этом случае сера участвовала в химическом процессе... Наука X. имеет задачей установление законов всяких таких превращений". В других учебниках физические превращения определены, как такие, при которых остаются неизмененными свойства материи, при восстановлении первоначального состояния ее; во время же процесса нельзя, кроме того, данную однородную часть превращающейся системы разделить на разнородные никаким механическим способом, по крайней мере, если мы исходим из физически однородного тела; так, напр., нагревание льда, его плавление, превращение образовавшейся жидкой воды при кипения в пар — суть процессы физические, потому что при восстановлении первоначальной температуры (и давления) лед оказывается в прежнем количестве со всеми присущими ему при данных условиях физич. свойствами; и хотя при температуре плавления льда мы можем иметь вещество воды одновременно в трех состояниях — твердом (лед), жидком (вода) и газообразном (пар) и можем их механически разделить (лед можно, напр., отфильтровать от жидкой воды), но ни лед, ни вода, ни пар никакими известными нам механическими способами далее не могут быть разделены на физически разнородные вещества. Если же лед испарить и образовавшийся пар нагреть до температуры 1500° — 2000°, то механическим процессом (с помощью диффузии, см. Диссоциация) можно выделить из массы перегретых паров газ, отличный от них по свойствам (смесь водорода с кислородом). При обратном охлаждении одна неизмененная вода превратится в лед, а газообразное тело, собранное отдельно и быстро охлажденное, сохранит свою газообразную природу; это будет, следовательно, пример химического превращения льда. Несмотря на то, что в учебниках легко подыскать еще много подобных примеров, и несмотря на то, что деление превращений материи на физические и химические освящено временем, оно, несомненно, резко односторонне, и потому неверно. Оствальд не прав уже потому, что в своем примере он сопоставляет совершенно несравнимые превращения. Изменения в свойствах серы, которые происходят в ней при изменении ее "энергии положения", можно оставить в стороне; теоретически они необходимы, но, во всяком случае, столь ничтожные, что они неуловимы не только с помощью наших чувств, но и с помощью чувств, изощренных самыми чувствительными современными приборами. Когда же мы слабо нагреваем серу, то имеем дело со следующими явлениями. Изучаемую систему, которую Оствальд называет серой, должно считать сложенной из двух независимых слагаемых (см. Правило фаз): из серы и кислорода воздуха [Азот и все остальные газообразные составные части его принимают в превращении слишком ничтожное участие, за исключением, может быть, следов влажности — см. Контактные явления, — и потому их присутствие можно игнорировать]; она находится при таких температурных условиях (переохлаждена), когда благодаря пассивным сопротивлениям взаимодействие между этими телами почти невозможно, или, если оно и идет, то со столь ничтожной, близкой к нулевой, скоростью, что уловить его мы совершенно не в состоянии. Всю систему в совокупности мы можем, следовательно, считать находящейся в состоянии ложного равновесии (faux equilibre) Дюгема, иначе малоустойчивой (ср. А. Горбов, "Закон Фаз", в "Физико-математич. Ежегоднике", II), способной при небольшом изменении условий равновесия к полному превращению; серу же, рассматриваемую в отдельности, т. е. — пренебрегая ее бесконечно медленной реакцией с кислородом, мы можем считать моновариантной системой из одного слагаемого (сера твердая + пар при наличности двух внешних факторов равновесия: темп. и давления), и известно, что законы, которым такая система подчинена (см. Правило фаз, l. с.), ничем не отличаются от законов, которым подчинена любая моновариантная система с любым числом независимых слагаемых, система соединяющихся СаО + СО 2 (или диссоциирующей CaCO 3), напр.; в механическом смысле твердая сера с ее парами образуют безразлично устойчивую систему. Но нагреем серу + кислород до 500° приблизительно; сейчас же по поверхности соприкосновения начинается их взаимодействие, сопровождаемое появлением света и тепла (система была переохлаждена): сера, как обыкновенно говорят, горит, но одинаково горит и кислород, встречаясь с парами серы; для обоих слагаемых мера устойчивости при взаимном соприкосновении превзойдена нагреванием, и система превратилась в неустойчивую, и очевидно, что незаконно сближать безразлично устойчивое состояние серы с неустойчивым состоянием ее же + кислорода; а пока сера оставалась в безразлично устойчивом состоянии, тогда, повторяем еще раз, физические изменения ее свойств, подчинялись такому же закону, как и "химическое" превращение в системе СаО + CO 2. С очень ничтожным изменением сказанное приложимо и к системе нагреваемых: льда, жидкой воды и ее паров. Пока лед, жидкая вода нагреваются одни, до тех пор при данном объеме системы возможно (при целом ряде температуры и давлений) сосуществование двух фаз: льда + пара, льда + воды жидкой, воды жидкой + пара; все это системы моновариантные и, как таковые, ничем не отличающиеся от диссоциирующего мела, от образующегося (диссоциирующего) треххлористого йода (см. Правило фаз, l. с.), т. е. от систем, для которых обычно предполагается, что происходящие в них превращения не физического, а химического характера. Но мы перегрели пары воды, с помощью особого приема (диффузии) [Этим способом вводится в условия равновесия системы новый фактор, а именно, капиллярные натяжения, и очень возможно, что этим изменяется характер равновесия (ср. следующее примечание).] нам удалось отделить часть такой системы, и мы предполагаем, что остальная, неотделенная масса пара отличается по физическим свойствам от отделенной части, что от обыкновенного пара она только отличается другим, большим содержанием энергии; но, очевидно, это только предположение, хотя, может быть, и наиболее простое, и наиболее вероятное; что же касается переохлажденной "гремучей смеси", то она не подлежит сравнению с водой, потому что такое сравнение было бы так же неудачно, как сравнение переохлажденной воды со льдом той же температуры; одна система (переохлажденная вода) малоустойчивая, с пассивными сопротивлениями (по Гиббсу), другая безразлично устойчивая, по крайней мере, при наличности двух внешних факторов равновесия: температуры и давления [Устроим мы из водорода, кислорода и воды газовую батарею Грове, т. е. введем мы в нее несколько добавочных факторов равновесия, и она станет равновесной, и превращения ее возвратимыми и при обыкновенной температуре.]. Резюмируя предыдущее, мы приходим к заключению, что обычные определения X. несколько узки, а более общее такое: X. есть точная естественно-историческая наука, изучающая законы изменений состояния материи [При этом совершенно не предрешается вопрос об единстве или сложности этой материи.]; она классифицирует их вокруг "химических" соединений, а эти последние — вокруг особых, стойких разновидностей материи, называемых "элементами" (о значении выражений "химическое соединение" и "элемент" — см. ниже закон постоянства состава). Можно, при этом изучении, возвратимые изменения состояния материи называть физическими и отличать от тех "химических" превращений, которые в наших условиях невозвратимы и протекают односторонне, но надо помнить, что до последнего времени и между этими превращениями часть признается физическими, таковы, напр., переход переохлажденных жидкостей в твердое состояние, кристаллизация пересыщенных растворов [Если подобные растворы рассматривать не с точки зрения концентрации независимых слагаемых а с точки зрения влияния на них температуры, как внешнего фактора равновесия, то их тоже должно признать переохлажденными системами.], хотя они ничем не отличаются от "химических" явлений, каковы: взрыв жидкой перекиси водорода, жидкого озона, гремучей смеси (водорода с кислородом, хлора с водородом [Наблюдения показали, что и на смесь кислорода с водородом влияет свет, ускоряющий превращение.]) и т. д. С изложенной точки зрения ясно, что обычно сообщаемые в химиях сведения являются односторонними и отрывочными, и что к ним должны быть присоединены многочисленные данные, включаемые обыкновенно в курсы физики, в курсы кристаллографии и т. д., и которые только в самое последнее время вошли в руководства так наз. физической химии. Намеченная эволюция началась сравнительно недавно, и нельзя предвидеть объема X. даже в недалеком будущем, но до известной степени прав Мах, говоря, что "в новейшее время открыты многие соотношения между физикой и X. Старая мысль, что X. можно рассматривать, как прикладную физику, в частности — прикладную механику, получила в этом новое ободрение... При отсутствии предвзятого взгляда кажется скорее вероятным, что X. будущего обнимет собой физику, а не наоборот" ("Prinzipien der Wдrmelehre", 1900, 5, 354); несомненно, что обе науки выиграют в однородности, если из физики будут перенесены в X. все те отделы, в которых изучаются изменения состояния материи, в зависимости от изменений запаса ее энергии.
Законы и гипотезы X. Основные законы X. могут быть разделены на общие качественные и общие количественные. Качественные законы.
I. Между ними на первом плане должен быть поставлен закон фаз Гиббса; он уже изложен ранее (см. Правило фаз, l. с.) и здесь можно ограничиться указанием, что наиболее общее выражение его есть:
v = п + е — r,
где v — число независимых вариаций внешних и внутренних факторов равновесия системы или число степеней ее свободы; n — число ее независимых слагаемых (внутренних факторов равновесия), или число тех тел, концентрация которых может быть независимо изменена; е — число внешних факторов равновесия (таковыми являются: температура, давление, капиллярное натяжение, электровозбудительная сила, различное напряжение силы тяжести и т. д.); r — число фаз, т. е. физически отличных состояний материи, разделенных (r — 1) числом поверхностей раздела. Это выражение вытекает из статей самого Гиббса, но написано впервые Вальдом ("Zeitschrift f. Ph. Ch." 18, 1895, 346), и значит, словами (ср. А. Горбов, ""Закон фаз", "Физик. Мат. Ежегод.", II), что каждое новое тело, вступающее в систему, и каждый новый внешний фактор ее равновесия, увеличивают на единицу степень свободы системы (число возможных фаз, возможных независимых вариаций температуры, давления и т. д.), а каждая новая фаза или вновь образующаяся поверхность раздела эту степень свободы понижает на единицу. Закон фаз является неоцененной руководящей нитью при изучении превращений материи.
II. Вторым общим качественным законом, определяющим направление превращения, является закон Гиббса-Ле-Шателье [Gibbs, "É quilibres chimiques", trad. par H. Le Chatelier", pp. X, 85 — 91 и H. Le Chatelier, "C. R.", 1884, p. 780 в его "Recherches experimentales et th éoriques s ur les equilibres chimiques", 1888, pp. 48, 210).], гласящий, что "всякое изменение любого фактора равновесия влечет за собой превращение в системе, которое стремится вызвать в этом факторе изменение, противоположное по знаку тому, которое ему сообщено". Этот закон тоже изложен ранее (см. Обратимость хим. реакций,).
Количественные, весовые законы.
I. Закон сохранения массы материи высказан Лавуазье в априорной форме: "Мы можем признать за аксиому, — говорит он, — что при всех превращениях, как искусственных, так и природных, ничто не создается вновь: одно и то же количество материи существует до опыта и после него [Дебус ("U é ber einige Fundamentalsatze der Chemie etc.", 1894, 6) считает родоначальником такого убеждения Демокрита из Абдеры, учившего, что из ничего может только получиться ничто и ничто существующее не может превратиться в ничто; цитировано Аристотелем в его "Физике" (I, 4)]. На этом принципе покоится возможность каких бы то ни было химических опытов, и мы принуждены благодаря ему всегда ожидать настоящего тождества, или равенства, между сущностями тел изучаемых и тех, которые могут быть извлечены из них анализом" (Lavoisier, "Oeuvres etc." I, 101); несомненно, однако, что это положение явилось у Лавуазье результатом многочисленных опытных наблюдений (см. Флогистон, Формулы и Химическая номенклатура). Так как для данной точки земного шара массы любых тел строго пропорциональны их весам, то мы можем сказать, что, по закону Лавуазье: при любом превращении вес превращающихся тел строго равен весу образующихся, и нетрудно видеть, что этот "химический" закон представляет частный случай другого, более общего, которому подчинены всякие перемещения материи, и заключающегося в том, что каждый раз, когда масса данного тела изменяется (увеличивается или уменьшается), то масса одного или нескольких окружающих тел претерпевает одновременное изменение, равное по величине, но противного знака (уменьшается или увеличивается) [Готье и Шарпи "Le ç ons de Chimie", 1900, 14] [Закон сохранения массы материи вполне параллелен закону сохранения энергии в физике (ср. В. Stevarta. P. G. Tait, "Unseen Universe", 1890).]. При синтезе Стасом йодистого и бромистого серебра из взвешенных количеств серебра, йода и брома, вес галоидных соединений оказался, однако, несколько меньше серебра и йода, серебра и брома, взвешенных в отдельности; кроме того, Л. Мейером ("Moderne Theorien d. Ch.", 1884, 135) указано на возможность того, что частички нашей весомой материи соединены с большим или меньшим количеством не вполне невесомого светового эфира, количество которого, может быть, меняется при химических превращениях; ввиду этого, сначала Ландольт, а за ним Гейдвейлер подвергли закон Лавуазье тщательной опытной проверке; оба изучали изменения веса различных систем, заключенных в запаянных стеклянных сосудах. Ландольт нашел, что вес системы: водный раствор серно-кислого серебра + подкисленный серной кислотой раствор железного купороса уменьшается при реакции:
Ag2SO4 + 2FeSO4 + H2SO4 = 2Ag + Fe2(SO4)3 + H2O
нa 0,130 мг — 0,167 мг; это уменьшение превосходит в 6 — 12 раз ошибку взвешивания, но оно непропорционально реагирующим массам, так как оно было = 0,130 мг при 171,3 г и 0,167 мг при 114,2 г реагирующей системы; при реакции йодной кисл. с йодистым водородом в присутствии серной кислоты:
HJO3 + 5H2SO4 + 5KJ = 3J2 + 5KHSO4 + 3H2 О
тоже наблюдалось уменьшение веса, но разница (0,011 мг — 0,047 мг) лежала в пределах погрешности опыта; при реакции йода с водным раствором сернисто-натриевой соли (взаимодействие может идти в двух направлениях:
J2 + 2Na2SO3 = 2NaJ + Na2S2O6
и
J2 + Na2SO3 + Η 2 Ο = 2HJ + Na2SO4,
хлоралгидрата с едким кали
[ССl 3.СН(ОН) 2 + КОН = СCl 3 Н + СНКО 2 + Н 2 О]
и при растворении хлоралгидрата в воде не наблюдено изменений в весе, которые не падали бы в пределы ошибок опыта. Гейдвейлер изучил следующие превращения: вытеснение меди железом в кислых, основных (?) и нейтральных растворах медного купороса, растворение медного купороса в воде, растворение его же подкисленного — в воде и среднего — в серной кислоте, осаждение гидрата окиси меди едким кали из раствора медного купороса, взаимодействие аммиака с уксусной кислотой и осаждение хлористого бария серной кислотой. При общем количестве реагировавших тел около 200 г (160 — 280) и при ошибке взвешивания, не превосходившей 0,04 мг, в двух случаях им была наблюдена прибыль в весе в 0, 014 и 0, 019, а в остальных 21 уменьшение в весе; в 13 опытах оно было больше возможной ошибки и раз дошло до 0,217 мг; с несомненностью уменьшение удалось установить при осаждении меди в кислом и щелочном растворе (но не в нейтральном), при растворении подкисленного медного купороса в воде и при осаждении гидрата окиси меди [В 2-х опытах, однако, наблюдалось уменьшение слишком ничтожное, а именно 0,037 и 0,032 мг]. Причину изменения веса Гейдвейлеру не удалось выяснить, а кроме того, потеря в весе не была пропорциональна массе реагировавших тел. Таким образом, оказывается, что, при некоторых превращениях, масса превращающейся материи как будто уменьшается, и это уменьшение лежит вне пределов погрешностей взвешивания; оно не может быть объяснено (Ландольт) различным напряжением всемирного тяготения по отношению к равным массам различных тел, так как опыты Бесселя с маятниками из различных металлов и минералов и Этвёша (E ötvö s) с крутильными весами показали, что такого различия не удается уловить; с другой стороны, как видно, отступления не пропорциональны реагировавшим массам, и это делает вероятным какую-нибудь случайную ошибку; пока можно, кажется, продолжать считать закон Лавуазье, в пределах точности современных методов наблюдения, совершенно точным. Во всяком случае, с погрешностями вроде вышеприводимых не приходится считаться при обыкновенных опытах [Для того, чтобы система из основного медного купороса с железом потеряла в весе после реакции 1 пуд, надо, судя по данным Гейдвейлера, взять в самом благоприятном случае несколько более 1000000 пуд. смеси. В самое последнее время Гейдвейлер сообщил ("Physikalische Zeitschiift", 1902), что вес радия в запаянной трубке уменьшается за сутки на 0, 02 мг, причем замечательно, что уменьшение в силу этого потенциальной энергии (= K×[(M Δт)/r 2]×r, где K пост., M масса земли, r — ее радиус, Δт изменение массы тела, притягиваемого Землей) = 0,02.600000000 мг см. = приблизит. 12,10 эргов, т. е. как раз энергии, излучаемой, по Беккерелю, радием за сутки. Сообщение Гейдвейлера предварительное.].
II. Закон постоянства состава химических соединений который можно формулировать таким образом: массы тел, образующих своим соединением новое тело, обладающее данной суммой физических и химических свойств, находятся в постоянном отношении и между собой, и к массе образованного тела, считается обыкновенно наиболее характерным для химии; она даже определяется иногда, как наука, изучающая состав и превращения лишь однородных тел, т. е. таких, которые характеризуются постоянством состава, которые представляют настоящие химические индивиды, и которым присвоено название определенных химических соединений, в отличие от механических смесей и неопределенных химических (?) соединений (см. Тихвинский, "Метод и система современной химии", СПб., 1900, 3 и 6). С другой стороны, можно найти об этом законе отзыв (Gautier et Charpy, l. с., р. 14), что "он представляет не что иное, как тавтологию. В самом деле, нет возможности иметь другого определения "определенного" соединения, кроме того, которое выводится из этого, так называемого, закона. Физических свойств недостаточно, чтобы характеризовать соединение; так, мы наблюдаем вполне определенные свойства для смеси воды со спиртом, взятых в определенном отношении (по весу), хотя на эту смесь никто никогда не смотрит, как на соединение. Тут, следовательно, нет настоящего закона, а есть констатирование факта, впрочем, очень замечательного. А именно, многие элементы могут образовать сложные тела, только соединяясь в определенных пропорциях, остающихся неизменными, каков бы ни был путь получения сложного тела; если один из элементов в избытке, то он останется, как таковой, после акта соединения". Еще резче говорит Вальд ("Zeitsch. f. ph. Ch.", 1897, 22, 256): "Закон постоянства состава должен рассматриваться, как эмпирический закон. Но и это не вполне правильно. Стоит только спросить себя, что сделает химик, если какое-нибудь вещество, считавшееся химическим соединением — и это бывает не так редко — окажется меняющим свой состав с изменением условий? Будет ли он сомневаться в правильности закона? Очевидно, нет; он только вычеркнет вещество из списка химических соединений... Дело в том, что не имеется других признаков, чтобы признать вещество за химическое соединение... Итак, опытом узнано, что некоторые сложные тела имеют постоянный состав. Признание, что все такие вещества, и только они одни, должны считаться химическими соединениями, произвольно. Следовательно, химические соединения обладают постоянным составом в силу определения, и по определению же те тела, которые не удовлетворяют этому условию, не признаются за химические соединения". Представляется, ввиду изложенного, интересным выяснить, в каком отношении закон постоянства состава находится к закону Лавуазье, историю его возникновения, и что мы в настоящее время должны считать механической смесью, неопределенными и определенными химическими соединениями. Закон Лавуазье требует, чтобы масса реагирующих тел была равна массе образовавшегося из них нового тела, но совершенно не предрешает количеств реагирующих тел; любые их количества, лишь бы они были больше нуля, удовлетворяют ему; закон Лавуазье не предрешает и вопроса о том, не могут ли тела реагировать в бесчисленных отношениях; закон постоянства состава говорит, что реакция возможна только при некотором определенном отношении реагирующих масс, но тоже не дает указаний относительно числа возможных соединений. Замечательно, что химики уже с давних пор инстинктивно были убеждены в постоянстве состава изучаемых ими тел; достаточно указать, что определением состава солей занимались: Бергман (между 1775—1784); Венцель (1777), Кирван и Рихтер (1790—1800); что Лавуазье, определив состав углекислоты и воды, занялся изучением состава органических соединений, которые он для этого сжигал, собирал образовавшуюся воду и углекислоту и по количеству их вычислял содержание в сожженном веществе углерода и водорода, и т. д.; а это, очевидно, было бы невозможно, если бы он допускал, что состав воды и углекислоты может меняться. Таким образом, убеждение в постоянстве состава сложных тел существовало давно, или вернее, никто не подозревал возможности чего-либо другого, но "закон" оставался не высказанным. Решительным противником его выступил Бертолле ("Recherches sur les lois de l'afпnnt é", 1801 и 1802 и "Essai de statique chimique", 1803). Он был убежден в том, что тела могут соединяться иногда во всевозможных отношениях, иногда же в известных пределах; причину этого ограничения он видел в том, что сила, с которой удерживаются в сложном теле составные части, должна падать с увеличением массы одного из реагирующих тел (с приближением его к состоянию насыщения и относительным уменьшением массы другого), а во-вторых, во влиянии температуры на сцепление и на естественную упругость реагирующих тел. Благодаря высокому авторитету Бертолле, благодаря остроумию, с которым были изложены эти воззрения, они приобрели много сторонников, тем более, что имевшиеся тогда аналитические данные во многом являлись прямым подтверждением правильности подобных взглядов. Противником идей Бертолле явился Пру (Proust, см. соотв. статью) [Пру приписана в этой статье идея о происхождении химических элементов из одной первичной материи, а именно водорода, но эта идея высказана английским врачом Праутом (Prout) (см.) и Вес атомов (см.).]; в целом ряде работ (1801—1808) он показал, что образование окисей, сернистых соединений и солей, вообще, связано с определенными и неизменными отношениями между массами находимых в них элементов, но что — это видно только, если мы отличаем механические и иные физически и химически неоднородные смеси от химических соединений. Закон постоянства состава последних, именно окисей, высказал Пру в 1801 г. в следующих словах (Корр, "Geschichte d. Ch.", II, 368): "Всегда неизменные пропорции, эти постоянные атрибуты, характеризуют настоящие соединения как искусственные, так и естественные, одним словом, этот pondus naturae, который так ясно усмотрен Сталем; все это, говорю я, не более во власти химика, чем избирательный закон, которому подлежат все соединения". "Определенные" соединения могут, по Пру, смешиваться друг с другом в неопределенных. отношениях, но продукт такого смешения не химическое соединение, а раствор. Бертолле счел (в своей "Statique chimique"), что воззрения Пру мало обоснованы, и между ними возгорелся спор, кончившийся в 1808 г., когда большинство современников склонилось на сторону Пру, после чего началось усиленное изучение определенных химических соединений. В настоящее время несомненно, что вопрос должен быть пересмотрен вновь. Чтобы дать понятие о современной точке зрения, остановимся на наиболее простом случае взаимодействия двух каких-нибудь тел, не образующих между собой того, что называется определенным соединением, но способных в известных условиях образовывать жидкие и по всем направлениям однородные системы. Как известно (ср. Правило фаз, Сплавы, Фракционированное выпаривание), прибавление тела В к телу А вызывает понижение темп. плавления тела А, и прибавление тела А к телу В вызывает понижение темп. плавления тела В, а потому, при нанесении всевозможных смесей, образованных этими двумя телами, на диаграмму температур и концентраций, мы получаем две пересекающиеся в эвтектической точке кривые, исходящие из температуры плавления А и В (см. рис.):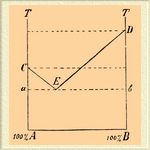
Детальное изучение диаграммы показывает следующее. Над кривыми СЕ и ED мы имеем область жидких систем, называемых обыкновенно раствором В в А (А плавится значительно ниже B), но которые, очевидно, настолько же и растворы А в В. Выше горизонтальной пунктирной линии, начинающейся из точки D, оба тела смешиваются в виде жидкостей во всех отношениях (от 100% А до 100% В); между этой линией и горизонтальной пунктирной линией, начинающейся в точке С, тело А, жидкое в этих условиях, может быть прибавляемо к раствору в неопределенном количестве, не нарушая его однородности, а прибавление тела В ограничено кривой его растворимости DE; раствор благодаря этому является как бы односторонним. Ниже горизонтальной пунктирной линии, начинающейся в точке С, оба твердых тела обладают ограниченной способностью плавить друг друга; раствор симметричен. Ниже пунктирной линии ab оба тела могут быть взяты в любых отношениях, но они не имеют никакого влияния друг на друга; они абсолютно индифферентны и при дальнейшем понижении температуры, и мы не в состоянии привести их в этих условиях во взаимодействие (внешними факторами равновесия системы предполагаются температура и давление пара A + В). В треугольнике СаЕ выпадает в твердом состоянии избыточное твердое тело A, находящееся в соприкосновении и равновесии с насыщенным им, телом A, раствором; в треугольнике DbE выпадает в твердом состоянии тело B, тоже находящееся в соприкосновении и равновесии с насыщенным им раствором. То, что лежит в прямоугольнике АаВb мы называем, обыкновенно, механической смесью, хотя собственно никакого смешения взятых тел тут не имеется [Отрицая смешение тел, мы имеем в виду их безразличное друг к другу отношение и их полную пространственную обособленность. Несомненно, что какой-нибудь эвтектический металлический конгломерат (см. Сплавы) на невооруженный микроскопом глаз производит впечатление однородного тела.]; они настолько же смешаны, как если бы находились и в отдельных приборах; потому более правильно называть такую "механическую" смесь вместе с Б. Роозебоомом (см. Стереоизомерия) конгломератом; составные части конгломерата могут быть отделены друг от друга различными приемами и, между прочим, с помощью тяжелых жидкостей (метод Черча и Тулэ в минералогии). Состав такого конгломерата может варьировать почти от 100% А до 100% B, но очевидно, что для каждой данной смеси он, при целом ряде изменений температуры, будет оставаться постоянным; и сочтем ли мы его определенным соединением, или нет, — будет зависеть от большей или меньшей легкости, с которой нам удастся доказать его физическую неоднородность в различных точках системы и от большей или меньшей доступности для нас эвтектической точки Е, выше которой неоднородность конгломерата скажется яснее (в твердом состоянии будет ими тело А или тело В), если только концентрация его не отвечает случайно эвтектической точке, когда и выше ее вещество будет относиться, как вполне однородное, для которого эвтектическая температура будет температурой плавления [Что такой конгломерат плавится при эвтектической температуре в однородную жидкость, доказано опытами Галлока (1888), нашедшего, что конгломерат опилок кадмия (1 ч.), олова (1 ч.), свинца (2 ч.) и висмута (4 ч.), отвечающий по составу сплаву Вуда, плавятся на водяной бане (при достаточно долгом нагревании), т. е. ниже 100°, между тем, как отдельные металлы плавятся: Cd при 320°, Sn при 32°, Рb при 320° и Bi при 269,2°; он же нашел, что достаточно прижать друг к другу свежими поверхностями калий (пл. при 62,5°) и натрий (пл. при 97,6°), чтобы получить их жидкий при обыкн. темп. и похожий на ртуть сплав (раствор).]. Затем тела А и В, выпадающие в твердом виде из раствора, будут тоже обладать неизменным составом, так как предположено, что они могут плавиться без разложения (изменения. состава) и кроме того предположено, что мы имеем такой случай взаимодействия их, когда при переходе в раствор меняется только их концентрация в единице объема, но не состав [Собственно говоря, такой идеальный случай не имеет места на самом деле: и кристаллы тела А, и кристаллы тела В выпадают, смоченные насыщенным раствором, состав которого меняется с температурой и может быть даже отличается благодаря капиллярности, по составу от остальной массы жидкости. Такой раствор, однако, сравнительно легко удалим, и этим обусловлено изложенное в тексте представление. Что кристаллы льда, выпадающего из "слабых" водных растворов, не представляют твердых растворов явствует из данных Реньо о давлении пара таких растворов, и из некоторых наблюдений Рюдорфа над слабыми водными растворами плеохроических солей.]. Наконец, раствор будет обладать переменной концентрацией, пока состав его будет отвечать площади, лежащей выше линий СЕ и ED, и пока один из внешних факторов равновесия, температура (при постоянном давлении) или давление (при постоянной температуре), системы будет меняться; но как скоро мы имеем раствор, отвечающий одной из пограничных кривых GE или ED, т. е. одной из двух возможных моновариантных систем, и значение температуры или давления системы даны заранее, или как скоро для растворов, лежащих выше СЕ и ED и представляющих дивариантные системы, закреплены значения температуры и давления, так оказываются вполне закрепленными, определенными и составы таких растворов, и давно известно, что состав насыщенных растворов определяется температурой и природой и состоянием твердого тела, находящегося с ними в соприкосновении, и что для того, чтобы иметь ненасыщенный раствор каких-нибудь тел, обладающий при данной температуре определенным давлением пара, желаемым и возможным удельным весом, желаемым коэффициентом светопреломления и т. д., что для всего этого реагирующие тела должны быть взяты в строго определенном "постоянном весовом отношении". Таким образом, мы приходим к заключению, что все инвариантные (нонвариантные) системы обладают определенным составом [Рассуждение, приложенное в тексте к системе из двух тел, может быть легко распространено на систему любой сложности. Не всегда конгломерат, лежащий ниже эвтектической температуры, будет состоять из чистых тел А и В; последний случай имеет место, когда А и В дают соединения. Но разобраться в таких случаях нетрудно, руководясь вышеизложенным в зная соответственную диаграмму; см, напр., диаграмму растворимости Fe 2Cl4 данную В. Роозебоомом в ст. Фракционированное выпаривание.]; постоянство его не представляет, следовательно, привилегии "определенных, химических" соединений, а потому настоятельно необходимо найти для "определенных, химических" соединений, описание которых составляет пока почти все содержание X., какой-нибудь, признак кроме постоянства состава, который позволял бы их характеризовать. Признак этот дан Вальдом, определившим постоянное химическое соединение, как фазу неизменного состава в моновариантной системе. В разобранном выше случае таковыми фазами являются твердые тела А и В в соприкосновении со своими насыщенными растворами: с возвышением температуры последних, с изменением их давления, состав раствора непрерывно меняется, а твердая фаза, хотя и меняется постоянно в количестве [Масса всей системы принята постоянной.], но сохраняет свой неизменный состав, свою индивидуальность. Несомненно, что признак, указанный Вальдом, давно был известен химикам, и они постоянно им пользовались при открытии &q
| "БРОКГАУЗ И ЕФРОН" >> "Х" >> "ХИ" >> "ХИМ" |
Статья про "Химия" в словаре Брокгауза и Ефрона была прочитана 1202 раз
| Пицца в сковороде |
| Панайпай |
TOP 15
- Волос
- Проно
- Степные животные
- Гимнастика
- Индийский океан
- Архитектура
- Сравнение, в литературе
- Манда
- Клитры
- Колесование
- Испарение
- Травоядные животные
- Оплодотворение у pacтений
- Вредные насекомые
- Электризация тел