


БНБ
"БРОКГАУЗ И ЕФРОН" (121188)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Фумаровая кислота
Определение "Фумаровая кислота" в словаре Брокгауза и Ефрона
Фумаровая кислота (хим.), бутендикислота С 4 Н 4O4 =С 2 Н 2 (СО 2 Н) 2 — стереоизомер (монотропный изомер? — ср. Фосфор, аллотропия) малеиновой кислоты (см.). Находится готовой в растительном царстве, а именно в Fumaria officinalis (Винклер), в исландском мхе (Пфаф), в Glaucium luteum (Пробст) и в различных грибах, как то: Agaricus piperatus (Bolley), Boletus pseudoignarius и др. (Dessaignes); ввиду связи Φ. кислоты с яблочной возможно, что в указанных случаях наблюдалась Ф. кислота, как результат превращения в условиях опыта кислоты HO 2C.CH(OH).CH2.CO2 Н, или какого-нибудь сложного производного ее. Ф. кислота образуется при отнятии элементов воды от яблочной кислоты:
C4H6O5 — Η 2 Ο = C4H4O4,
или двух атомов водорода от кислоты янтарной:
C4H6O4 — H2 = C4H4O4.
Так, она получена из яблочной кислоты при нагревании ее до 150° (Лассень, Пелуз), при кипячении ее с соляной (Dessaignes) или бромисто-водородной (Кекуле) кислотами, действующими как водоотнимающие средства; при обработке водой хлорангидрида, получающегося при действии PCl 5 на яблочнокислый кальций (Перкин, Дуппа):
C4H4O5Ca + 3PCl5 = C4H2O2Cl2 + CaCl2 + 3РОСl 3 + 2НСl
и C 4H2O2Cl2 + 2Н 2 О = C 4H4O4 + 2HCl.
Она же образуется при плавлении сульфоянтарной кислоты с KOH (Messet):
С 4 Н 5 (SО 3H)O4 + 3KOH = C4H2O4K2 + KHSО 3 + 3Н 2 О;
при нагревании выше точки плавления монобромоянтарной кислоты:
C4H5BrO4 = C4H4O4 + HBr,
или при выпаривании спиртового раствора монойодоянтарной кислоты (Brunner, Chuard):
C4H5IO4 = C4H4O4 + НI,
из дибромо- или изодибромоянтарных кислот при кипячении их с йодистым калием и медью (Swarts):
C4H4Br2O4 + 2KI = C4H4I2O4 + 2KBr = C4H4O4 + I2 + 2KBr
и I 2 + 2Сu = Cu 2I2.
Хлорангидрид Ф. кислоты образуется при действии хлора на кипящий хлорангидрид янтарной кислоты (Kauder):
C4H4O2Cl2 + Сl 2 = C4H2O2Cl2 + 2HCl,
а ее этиловый эфир — при действии цинковых стружек на дибромо- или изодибромоянтарные эфиры в присутствии влажного обыкновенного (серного) эфира (Михаэль, Шультгесс):
С 4 Н 2 Вr 2 О 4 (С 2 Н 5)2 + Zn = С 4 Н 2 О 4 (С 2 Н 5)2 + ZnBr2;
при кипячении диазоянтарного эфира с водой (Curtius, Koch)
(N2) С 4 Н 2 О 4(C2H5)2 = N2 + С 4 Н 2 О 4 (С 2 Н 5)2.
Из производных янтарной кислоты Ф. кислота получена при кипячении с HCl хлорэтенилтрикарбонового эфира (Бишоф):
(Н 5C2)О 2 С.CH 2.ССl(CO 2.С 2H5)2 + 3Н 2 О = С 4 Н 4 О 4 + CO2 + HCl + 3C2H5(OH),
и при медленном нагревании дикарбинтетракарбоновой кислоты (Бишоф):
(НО 2 С) 2C:C(CO2 Н) 2 = С 4 Н 4 О 4 + 2CO2;
впрочем, последняя реакция сложнее, чем это можно ожидать по приведенному уравнению, так как при быстром нагревании той же исходной кислоты Бишофом получен ангидрид пироцинхоновой (см. Пиридин), иначе диметилмалеиновой кислоты: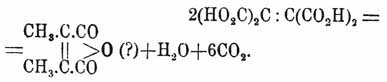
Менее ясными реакциями образования Ф. кислоты являются: образование ее при кипячении малоновокислого серебра с дихлороуксусной кислотой в присутствии небольшого количества воды (Komnenos):
C3H3O4Ag2 + Cl2.C2H2O4 = С 4 Н 4 О 4 + 2AgCl + CO2 (?),
при обработке аспарагина йодистым метилом в присутствии едкого кали (K örner, Menozzi):
HO2C.CH2.CH(CONH2).NH2 + CH3 I + KOH = С 4 Н 4 О 4 + CH3NH2 + NH3 + KI
[Очень возможно, что метиламин и аммиак в условиях опыта превращаются в йодистый тетраметиламмоний; отщепление от амидокислоты аммиака под влиянием едкой щелочи, без замещения группой (ОН), представляет не совсем обыкновенную реакцию.], при нагревании с разбавленной азотной кислотой — 4,4-дибромциклопентен-(1)-диона(3,5) наряду с дибромдинитрометаном, щавелевой и трибромацетилакриловой кислотами (Woiff, Rudel):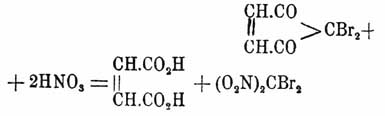 (дибромдинитрометан)
(дибромдинитрометан)
[Найденная тут Вольфом трибромацетилакриловая кислота есть 5,5,5-трибромпентен-(2)-он(4)-кисл.(1): СВr 3.СО.СН:CH.CO 2 H и при действии соды она распадается на бромоформ и малеиновую кислоту:
СВr 3.CO.CH:CH.CO2 H + Н 2 O = СHВr 3 + HO2 C.СН:CH.CO 2H;
если возможна такая реакция гидратации и под влиянием кислот, то образование Ф. кислоты можно объяснить изомеризацией малеиновой кислоты; Ф. кислота не представляет тогда первичного продукта превращения непредельного дикетона, как можно предполагать на основании уравнения, приведенного в тексте.] и, наконец, при действии концентрированной царской водки на протеиновые вещества (Mullh ä user). Затем Ф. кислота может быть получена изомеризацией малеиновой кислоты под влиянием малых количеств галоидоводородных кислот (Кекуле, Штреккер) [Этим обстоятельством объясняется, что Кариус получил гидратацией трихлорфеномалевой кислоты (трихлорацетилакриловой — ССl 3.OC.CH:CH.CO2 Н) не малеиновую кислоту, а Ф. кислоту (Kekule, Strecker).], при нагревании ее в запаянной трубке (можно и в присутствии воды) до 210° (Танатар, Скрауп), при кипячении с насыщенным раствором роданистого кадия (Михаэль). Нитрил Ф. кислоты может быть синтезирован действием K CN на твердый дийодацетилен (Кайзер):
C2H2I2 + 2KCN = C2H2(CN)2 + 2KI.
Для получения Ф. кислоты удобны только: долговременное нагревание яблочной кислоты на масляной бане при 140—150° (Ваеуеr), или кипячение с малым количеством воды обромленного бромистого сукцинила (Volhard):
C4H3BrO2Br2 + 2Н 2 О = C 4 Н 4 О 4 + 3НВr.
Ф. кислота кристаллизуется (из воды) в коротких призмах или маленьких иглах, реже широких листочках; под обыкновенным давлением с заметной скоростью возгоняется почти без разложения (?) при 200°; плавится в запаянной трубке при 286—287° (Михаэль); неизвестно, что представляет собой расплавленная Ф. кислота, но можно, однако, считать установленным, что при сильном нагревании (с частичным обугливанием?) Ф. кислота распадается на малеиновый ангидрид и воду, а потому не невероятно, что при температуре плавления, т. е. при сосуществовании трех фаз: твердой + жидкой + парообразной, твердая Ф. кислота находится в равновесии с жидким, плавящимся при 60° малеиновым ангидридом (с примесью воды) [Малеиновая кислота плавится при 130°, диссоциируя на воду и ангидрид.] и с парообразной фазой, состоящей из газов, малеинового ангидрида и воды. Удельный вес твердой Ф. кислоты = 1,625 (Танатар и Челибеев), т. е. выше удельного веса малеиновой кислоты, равного 1,590 (Танатар и Челибеев). Растворима (Кариус) при 16,5° в 143,7 весовых частях воды (малеиновая кислота при 10° растворяется в 10 весовых частях воды, Lassaigne); в спирте она растворима значительно труднее малеиновой кислоты и т. д.; теплота нейтрализации едким натром равна 26,597 калорий (Галь, Вернер; для малеиновой кислоты та же величина равна 26,620), теплота растворения (в воде) равна —5,901 (Галь, Вернер; для малеиновой кислоты равна 4,438), теплота горения равна 319,178 калорий (Лугинин), 320,7 калорий (Штоман), тогда как для малеиновой кислоты последняя величина равна 327,480 (Лугинин); малеиновая кислота превращается в Ф., следовательно, с выделением тепла, что объясняет возможность превращения под влиянием контактных (например, KCNS) и каталитических (галоидоводородные кислоты; см. выше) агентов. При действии PCl 5 Ф. кислота образует собственный хлорангидрид (Кекуле), жидкость состава С 2 Н 2(COCl)2, кипящую при 160°; то же вещество образуется при действии PCl 5 на яблочную кислоту (Перкин, Дуппа) и на малеиновый ангидрид (Перкин) [Малеиновый ангидрид образуется при действии P 2O5 на Ф. кислоту (Танатар).]; реагируя с серебряной солью Ф. кислоты этот хлорангидрид образует малеиновый ангидрид по уравнению (Перкин):
С 2 Н 2(COCl)2 + (AgO2C)2H2C2 = 2С 2 Н 2.C2O3 + 2AgCl;
та же реакция должна, очевидно, иметь место при действии хлорангидрида на малеиновокислое серебро, а потому трудно сказать — отчего он считается хлорангидридом Ф., а не полимером хлорангидрида малеиновой кислоты; обратное получение из него при действии воды Ф. кислоты не решает вопроса, ввиду того, что образующаяся одновременно хлористо-водородная кислота:
С 2 Н 2(COCl)2 + 2HOH = С 2 Н 2 (CO.OH) + 2НСl
должна изомеризовать малеиновую кислоту, если бы она и являлась первым продуктом реакции. Амальгама натрия восстановляет Ф. кислоту в янтарную:
C4H4O4 + H2 = С 4 Н 6 О 4;
того же можно достигнуть нагреванием С 4H4 О 4 с дымящейся HI в запаянных трубках, или под влиянием цинка в присутствии едкой щелочи, но не при растворении Zn в Ф. кислоте (Кекуле). При электролизе концентрированного раствора Na-соли Ф. кислоты, на аноде появляются ацетилен и CO 2, а на катоде янтарно-натриевая соль (Кекуле); так как последняя, в свою очередь, распадается при электролизе на этилен и CO 2, то, вероятно, что к ацетилену примешивается некоторое количество этилена. С бромом в присутствии воды Ф. кислота реагирует при обыкновенной температуре довольно медленно (благодаря малой растворимости Ф. кислоты в воде, van't-Hoff), реакция легко идет при 100° и ведет к образованию дибромоянтарной кислоты; при 100° же Ф. кислота легко соединяется с HBr (нагревание в запаянной трубке с насыщенным при 0° водным раствором), образуя монобромоянтарную кислоту:
С 4 Н 4 О 4 + HBr ↔ С 4 Н 5 ВrО 4.
Диэтиловый эфир Ф. кислоты, реагируя с натрмалоновым эфиром, образует соединение, дающее при омылении трикарбаллиловую кислоту (ее соль), спирт и CO 2 (Михаэль, Шультгесс):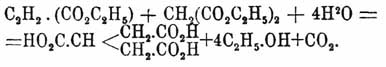
При нагревании с едкой щелочью Ф. кислота образует оптически недеятельную яблочную кислоту, а при окислении марганцово-калиевой солью — виноградную кислоту (Танатар, Кекуле, Аншютц):
С 4 Н 4 О 4 + O + H2 O = С 4 Н 6 О 6
(см. Винная кислота). Ф. кислота двухосновна; известны многочисленные соли ее и сложные эфиры; последние получаются действием Ф. кислоты на соответственные спирты в присутствии H 2SO4 (в присутствии HCl и спиртов наряду с эфирами Ф. кислоты образуются и эфиры хлороянтарной кислоты); замечательно, что те же эфиры образуются из малеиновых эфиров изомеризацией под влиянием следов йода (Аншютц). Ангидрида Ф. кислоты неизвестно; по крайней мере, Аншютц нашел, что чистый хлорангидрид уксусной кислоты при высокой температуре разрушает (?) Ф. кислоту, а на холоде он дает с нею продукт, из которого при перегонке можно выделить малеиновый ангидрид и небольшое количество ангидрида хлороянтарной кислоты (Перкин). От малеиновой кислоты Ф. отличается, кроме точки плавления и растворимости (см. выше), неспособностью давать анилид при кипячении с анилином (Аншютц), осаждаемостью в водных растворах из натриевой соли соляной кислоты и отсутствием осадка при действии BaC l2 на раствор Na-соли. Известны многочисленные хлоро-, бромо- и йодопроизводные Ф. кислоты, на которых, за недостатком места, нельзя останавливаться. Изучение Ф. и малеиновой кислот многократно занимало химиков; впервые внимание всех было обращено на эти кислоты, благодаря работам Кекуле, наблюдавшего на малеиновой кислоте первый пример кислоты, необыкновенно легко вступающей в соединение с HBr; это обстоятельство было неожиданно, так как принималось, что такой способностью могут обладать только вещества щелочного характера. С развитием теории строения (см. Химическое строение) вопрос об изомерии этих кислот особенно выдвинулся, так как оказалось, что структурные формулы того времени не могли передать без натяжек отношения обеих кислот друг к другу, и в то же время их близость к янтарной и яблочной кислотам, строение которых (и особенно симметричное строение первой) считалось достаточно выясненным. Кекуле остановился сначала на мысли, что строение Ф. кислоты выражается формулой HO 2C.CH:CH.CO2 Н, т. е., что она представляет симметрично двукарбоксилированный этилен, и что строение малеиновой кислоты отвечает формуле: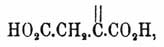
т. е. что она представляет то же двузамещенное производное, но не обыкновенного этилена (см.) Н 2C:CH2, а его изомера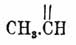
где один из углеродных атомов является не четырех-, а двухатомным; место двух свободных сродств он назвал L ü cke (пустота) и считал, что присутствием такой пустоты и объясняется необыкновенная способность малеиновой кислоты к реакциям присоединения. С течением времени гипотеза пустот или, что то же, гипотеза двухатомного углерода, потеряла, однако, кредит [Одним из поводов к этому было неполучение изомерных пропиленов из двух известных изомеров формулы С 3 Н 5 Вr 2, теперь 2 изомера С 3 Н 6 — пропилен и триметилен — известны.], и во многих учебниках можно было найти для Ф. кислоты вышеприведенную формулу, а для малеиновой формулу — СН 2:C(CO2H)2, по которой она являлась метиленмалоновой кислотой, несмотря на то, что малеиновая кислота не обладает способностью малоновой и замещенных малоновых кислот легко распадаться при нагревании с выделением элементов СО 2 [В настоящее время метиленмалоновая кислота известна (Зелинский, Танатар) и она оказалась изомерной с малеиновой.]. В таком неопределенном положении вопрос был до появления стереохимических представлений (см. Стереохимия и Стереоизомерия), когда Вантгофф (1877) сразу высказал предположение, что малеиновой кислоте, ввиду ее легкой способности к образованию ангидрида, должно приписать пространственную формулу со сближенными карбоксилами, а именно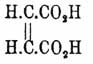
а Ф. кислоте стереоизомерную формулу с удаленными карбоксилами: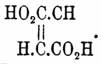
В 1882 г. к этому воззрению присоединился и Лебель, нашедший в наблюдениях Танатара, Кекуле и Аншютца над окислением этих кислот марганцово-калиевой солью (см. Винная кислота) прямое доказательство того, что в этилене и непосредственных продуктах замещения его водорода, атомы, образующие молекулу, лежат в одной плоскости. С тех пор это воззрение является почти общепринятым и попытки Аншютца, Розера, Танатара, Скраупа и Делиля, считавших возможной структурную изомерию между названными кислотами (Ansch ü tz, Roser) или же указывавших на несогласие наблюдаемых фактов с пространственными толкованиями Вислиценуса ("Berichte der S ächsischen Academie" — см. литературу в ст. Стереоизомерия и Liebigs, "Ann.", 246), — не имели никакого успеха. При отсутствии предвзятого взгляда нельзя не обратить внимания на полный параллелизм отношений малеиновой и Ф. кислот с отношениями белого и красного фосфоров (см. Фосфор, аллотропия). Параллелизм этот сказывается в том, что при обыкновенных температурах малеиновая кислота, подобно белому фосфору, представляет менее устойчивое видоизменение, легко превращающееся в устойчивую форму под влиянием контактных (каталитических) агентов; подобно белому же фосфору при высоких температурах большей устойчивостью обладает та же малеиновая кислота (ее ангидрид); отношение температур плавления и удельных весов одно и то же; в обоих случаях форма менее устойчивая при обыкновенной температуре обладает более низкой температурой плавления и более низким удельным весом; в обоих случаях более трудноплавкая форма не плавится, а только возгоняется под обыкновенным давлением; отношения растворимости те, которых следует ожидать: малеиновая кислота, как менее устойчивая, обладает несравненно большей растворимостью; химическая энергия малеиновой кислоты больше химической энергии Ф. кислоты, и то же известно для белого и красного фосфоров; наконец, как показывают теплоты горения, превращение малеиновой кислоты в Ф. должно быть экзотермическим подобно превращению белого фосфора в красный. Таким образом, в высшей степени вероятно, что обе кислоты являются монотропными изомерами и что та же диаграмма, которая передает отношения аллотропных разновидностей фосфора, должна передать, и притом в мельчайших подробностях, отношения фумаровой и малеиновой кислот. Представляет ли Ф. кислота полимерное видоизменение малеиновой кислоты, или нет, этот вопрос пока не может быть решен по недостатку положительных данных совершенно так же, как и для красного фосфора (см.) [Неудачная попытка Кекуле и Аншютца разделить Ф. кислоту на два изомера не может иметь решающего значения, во-первых, потому, что они искали, по-видимому, оптически деятельных изомеров, а скорее можно ожидать кислот, стоящих в таком же отношении к Ф. кислоте, в каком находятся кислоты ита- и цитраконовые к кислоте мезаконовой, а во-вторых, и потому, что возможны и явления частичной рацемии (см. Стереоизомерия).].
А. И. Горбов.
| "БРОКГАУЗ И ЕФРОН" >> "Ф" >> "ФУ" >> "ФУМ" |
Статья про "Фумаровая кислота" в словаре Брокгауза и Ефрона была прочитана 3758 раз
| Бургер двойного помола |
| Чистим кильку легко и просто |
TOP 15
- Волос
- Проно
- Степные животные
- Гимнастика
- Индийский океан
- Архитектура
- Сравнение, в литературе
- Манда
- Клитры
- Колесование
- Испарение
- Травоядные животные
- Оплодотворение у pacтений
- Вредные насекомые
- Электризация тел