


БНБ
"БРОКГАУЗ И ЕФРОН" (121188)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Фениламины
Определение "Фениламины" в словаре Брокгауза и Ефрона
Фениламины или анилины. — Под этим названием подразумеваются такие соединения ароматического ряда, в которых один или несколько атомов водорода бензольного ядра замещены группами NH 2; следовательно, простейший Ф. будет иметь формулу C 6H5—NH2. Очевидно, гомологи бензола образуют и соответствующие гомологи простейшего Ф., или анилина (см.). Ф. теоретически могут быть производимы двояким путем: 1) постепенным замещением атомов водорода в аммиаке фенильными остатками, и тогда мы получим, как и в жирном ряду, моно-Ф. C 6H5—NH2, ди-Ф. (C 6H5)2 NH и три-Ф. (C 6H5)3 N; тетрафениламмониевых оснований до сих пор неизвестно. Понятно, что этим путем можно образовать и смешанные Ф., в которых атомы водорода аммиака замещены различными ароматическими или жирными радикалами, например:
метилфенилтолиламин и т. д. 2) Постепенным замещением одного, двух, трех и т. д. атомов водорода бензольного кольца группами NH 2. В этом случае образуются гомологические ряды: фенилендиаминов, триамидобензолов и т. д., формулы простейших членов которых последовательно будут C 6H5NH2, C6H4(NH2)2, C6H3(NH2)3 и т. д. На практике до сих пор удалось заместить только пять атомов водорода бензольного ядра, и след., указанные ряды полиаминов заканчиваются рядом пентаамидобензолов с простейшим членом C 6H(NH2)5, носящим название пентаамидобензола. Получаются первичные (см. Амины) моно- и поли-Ф. главным образом из соответствующих нитросоединений:
C6H5NO2 +3H2 = C6H5NH2 + 2H2O;
C6H4(NO2)2 + 6H2 = C6H4(NH2)2 + 4H2O
и т. д., причем реакция эта ведется в большинстве случаев в кислом растворе и восстановителями служат или олово, или цинк, которые с кислотой выделяют водород, действующий на нитросоединение. Из кислот здесь удобнее брать соляную; но в некоторых случаях получения более сложных аминов в присутствии этой кислоты наблюдается хлорирование продукта, а потому часто соляную кислоту заменяют серной или уксусной и вместо олова тогда берется или цинк или железо. При указанной обработке полинитросоединений всегда все группы NO 2 восстановляются в группы NH 2; но возможно, употребляя менее энергичные восстановители, восстановлять постепенно группы NO 2. Для этой цели обыкновенно пользуются реакцией, открытой Зининым, именно восстановляют сернистым водородом и непременно в щелочном растворе. Таким способом, напр., легко получается нитроанилин из динитробензола:
С 6 Н 4(NO2)2 + 3H2S =C6H4(NO2)—NH2+2H2O+3S.
Однако, в случае более продолжительного действия сероводорода и, особенно, при нагревании восстановляется и вторая группа
NO2 = C6H4(NO2)NH2 + 3H2S = C6H4(NH2)2 + 2H2O + 3S
a в некоторых случаях присутствие в растворе щелочи может разлагать образующийся амин с выделением аммиака и образованием фенола (см.). Указанные реакции восстановления нитроароматических соединений совершаются, несомненно, в нескольких фазах. Так, ввиду того, что азотная кислота и ее производные вообще при осторожном восстановлении легко переходят в азотистую кислоту и ее производные и ввиду того, что нитротела, восстановляясь в кислом растворе, дают те же продукты, что и нитрозотела, то представляется весьма вероятным, что прежде всего нитротела и переходят в нитрозо-:
R—NO2 + 2H = R—NO + H2O.
При дальнейшем же восстановлении, как уже доказано Бамбергером, образуются β-фенилгидроксиламины:
R—NO + H2 = R—NH—OH
которые уже с новой молекулой водорода образуют амины
R—NH—ОН + H 2 = RNH2 + Н 2 О.
Кроме указанных реакций, можно еще получать Ф. заменой гидроксила (ОН) в фенолах (см.) амидогруппой. Для этой цели обыкновенно нагревают фенол с соединением хлористого цинка и аммиака ZnCl 2—NH3 при темп. 300—350°:
С 6 Н 5 ОН + NH 3 = C6H5NH2 + Н 2O.
Однако способ этот очень редко употребляется в практике, так как выходы амина здесь малы и требуется очень высокое нагревание. Далее, первичные Ф. образуются при сухой перегонке хлористоводородных солей смешанных жирноароматическ. вторичных аминов:
C6H5NHCH3—HCl = C6H5NH2 + CH3Cl.
Реакция эта имеет тоже только теоретический интерес и применяется иногда для доказательства строения того или другого амина. Из этого краткого обзора главнейших способов получения первичных Ф. видно, что наибольшее значение имеет реакция восстановления нитро- или нитрозосоединений; в технике эта реакция также имеет громадное значение, но она требует в качестве исходного материала нитросоединения, которое получается исключительно нитрацией бензольного кольца, в частности ароматических углеводородов, из этих же последних только бензол, толуол, нафталин и антрацен имеются на заводах в значительных количествах, тогда как их гомологи получаются с таким трудом и, кроме того, нитруются с такими плохими выходами, что технике для получения их аминов пользуется способом Гофманна, который заключается в том, что хлористоводородную или сернокислую соль данного Ф. нагревают в автоклавах с абсолютным метильным спиртом при температуре около 300—350°; при этом в первую фазу реакции образуется соль вторичного метил-Ф.: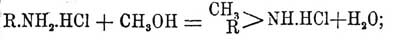
далее эта соль разлагается с выделением первичного Ф. и хлористого метила: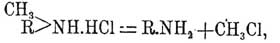
этот же последний при высокой температуре реакции конденсируется с бензольным ядром:
R—NH3 + CH3Cl = R'(CH3)NH2 + НСl;
конденсация эта всегда происходит таким образом, что метильная группа всегда соединяется с углеродом бензольного кольца, находящимся в параположении к группе NH 2, если же это место занято, то соединение происходит в ортоположении; при занятых р- и о-местах реакция не идет. Таким путем на химических фабриках получают главным образом несимметрический m -ксилидин из р-толуидина: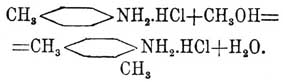
В лабораториях это почти единственный удобный способ для получения тетра- и пентаметиламидобензолов. Этою же реакциею получаются дифениламин (C 6H5)2 NH и его гомологи: дитолиламин (С 6 Н 4—CH3)2 NH и т. д.; понятно, что в этом случае приходится брать не спирт, а соответствующий фенол:
С 6 Н 5 NН 2 —НСl + С 6 Н 5 НО = (С 6 Н 5)2 NН + H 2 O + НСl.
Есть еще и другие способы получения вторичных Ф., но они имеют главным образом теоретический интерес. Так, напр., подобно тому, как в присутствии хлористого цинка при помощи аммиака в феноле можно заместить гидроксил амидогруппой, так же точно при помощи анилина его можно заместить амидофенильным радикалом, и в таком случае получится дифениламин:
C6H5OH + NH2C6H5 = C6H5NH—C6H5 + H2O.
Третичные Ф. получаются действием при нагревании натриевых солей вторичных Ф. на бромбензолы:
(C6H5)2N—Na + C6H5Br = (C6H5)3N + NaBr.
Что касается свойств Ф., то, с одной стороны, они напоминают жирные амины (см.) с несколько ослабленным основным характером, с другой же — им присущи и некоторые особенности, резко отличающие их от этих последних. Так как, вообще говоря, бензольное кольцо всегда придает соединениям слабо отрицательные свойства, то ничего нет удивительного, что при соединении с сильно положительной группой NH 2 фенильного остатка щелочные свойства ее сильно ослабляются и в первичных Ф. мы имеем пример сравнительно слабых оснований, однако, способных все-таки с минеральными кислотами давать соли, а с галоидопроизводными спиртов — вторичные, третичные и до четверичных аммониевых оснований:
С 6 Н 5 NН 2 + CH3 J = С 6 Н 5 NН—CH 3—HJ
C6H5NH2 + 2CH3J = C6H5N(CH3)2 —HJ + HJ и
C6H5NH2 + 3CH3J = C6H5N(CH3)3J + 2HJ.
При замещении водородов бензольного кольца отрицательными радикалами Ф. еще более теряют свои основные свойства, так что, наприм., соли нитро-Ф. (особенно полинитро-Ф.) уже разлагаются водой. Точно так же теряются основные свойства аминов при замещении атомов водорода их амидогруппы фенилами, так что, напр., ди-Ф. уже образует соли только с очень крепкими кислотами и соли эти с легкостью при действии воды распадаются на свои компоненты. Три-Ф. солей с минеральными кислотами не образуют и по своему характеру являются совершенно индифферентными веществами. Подобно аммиаку, свободные Ф. при нагревании с металлическим калием или натрием способны обменивать свой водород амидогруппы на эти металлы; известны, напр. анилин-калий и дикалий-анилин C 6H5 NHK и C 6H5NK2; точно так же известен и натрий-ди-Ф. (C 6H5)2 NNa. Соединения эти прочны, однако, только в индифферентной среде и разлагаются уже водой на холоду по уравн.:
C6H5NHK + H2O = C6H5NH2 + КНО.
Особенно же характерной особенностью Ф., резко отличающей их от жирных аминов, является отношение их к азотистой кислоте. Так, первичные Ф. при действии азотистой кисл. без охлаждения разлагаются, подобно соответствующим жирным аминам, на фенол, азот и воду
C6H5NH2 + HNO2 = C6H5—OH + N2 + Н 2O;
если же реакцию вести около 0° и в кислом растворе, то получаются диазосоединения (см.). При действии азотистой кислоты на вторичные Ф. получаются, подобно тому как и в жирном ряду, нитрозоамины (см.). При действии HNO 2 на третичные Ф. получаются р-нитрозоанилины:
С 6H5 N(СН 3)2 + HNO2 = NO—C6H4N(CH3)2 + H2O
(ср. в ст. Нитрозоамины превращение нитрозометиланилина в паранитрозометиланилин). Весьма интересны также реакции конденсации о-фенилендиаминов с различными телами (см. Фениленамидины, Хиноксалины, Феназины). Из отдельных представителей Ф. наибольший интерес представляют: из первичных — простейший Ф., или анилин С 6 Н 5NH2, и его гомологи толуидины СН 3 С 6 Н 4NH2, ксилидины (CH3)2C6H3NH2 и кумидины (CH3)3C6H2NH2 и друг., затем фенилендиамины C6H4(NH2)2 и толуилендиамины CH3C6H3(NH2)2, триамидобензолы C6H3(NH2)3, из вторичных метиланилин C6H5—NH—CH3 и дифениламин (C6H5)2 NH, из третичных диметиланилин C6H5N(CH3)2, трифениламин (C6H5)3 N. Физические их свойства приведены в нижеследующей таблице [Об анилине, дифениламине, трифениламине и толуидинах см., кроме того, соответствующие статьи, а также Нитробензол и Краски органические искусственные (получение в технике и применение).]:
| Название | Удельный вес | Точка плавления | Точка кипения |
| Анилин | 1,0361 (0°) | —8° | 184° |
| о-Толуидин | 1,003 (20°) | —20° | 197° |
| m- Толуидин | 0,998 (25°) | жид. | 199° |
| p- Толуидин | 1,046 | 45° | 198° |
| Ксилидин 1, 2, 3 *) | 0,991 (15°) | жид. | 223° |
| Ксилидин 1, 2, 4 | 0,918 (25°) | жид. | 212° |
| Ксилидин 1, 2, 5 | 0,980 (15°) | 15,5° | 213,5° |
| Ксилидин 1, 2, 6 | — | жид. | 216° |
| Ксилидин 1, 3, 4 | 1,0755 (17,5°) | 49° | 226° |
| Ксилидин 1, 3, 5 | 0,993(0°) | жид. | 220—221° |
| Кумидин 1, 3, 4, 5 | 67—68° | 245° | |
| Кумидин 1, 2, 3, 6 | — | жид. | 236° |
| Кумидин 1, 2, 4, 5 | — | 68° | 234—235° |
| Кумидин 1, 2, 3, 5 | — | 36° | — |
| Кумидин 1, 2, 4, 6 (мезидин) | 0,9633 | жид. | 229—230° |
| о-Фенилендиамин | — | 102° | 252° |
| m- Фенилендиамин | — | 63° | 287° |
| p- Фенилендиамин | — | 147° | 267' |
| Толуилендиамин: | |||
| [1CH3 2, 3] | — | 61° | 255° |
| [1CH3 3, 4] | — | 88° | 265° |
| [1CH3 2, 4] | — | 99° | 280° |
| [1СН 3 2, 6] | — | 103° | — |
| [1СH 3 3, 5] | — | жид. | 284° |
| [1CH3 2, 5] | — | 64° | 273° |
| Триамидобензол: | |||
| 1, 2, 3 | — | 103° | 330° |
| 1, 2, 4 | — | 132° | 340° |
| Метиланилин | 0,976 (15°) | жид. | 192° |
| Диметиланилин | 0,957 (20°) | 0,5° | 192° |
| Дифениламин | 1,159 | 54° | 310° |
| Трифениламин | — | 127° | выше 340° |
*) В этом столбце цифры обозначают атомы углерода бензольного кольца, связанные с боковыми цепями, причем в моноаминах принято, что группа NH 2 всегда связана с углеродом 1.
Д. Хардин. Δ .
| "БРОКГАУЗ И ЕФРОН" >> "Ф" >> "ФЕ" >> "ФЕН" |
Статья про "Фениламины" в словаре Брокгауза и Ефрона была прочитана 1973 раз
| Английское куриное карри |
| Английское куриное карри |
TOP 15
- Волос
- Проно
- Степные животные
- Гимнастика
- Индийский океан
- Архитектура
- Сравнение, в литературе
- Манда
- Клитры
- Колесование
- Испарение
- Травоядные животные
- Оплодотворение у pacтений
- Вредные насекомые
- Электризация тел