


БНБ
"БРОКГАУЗ И ЕФРОН" (121188)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Топки
Определение "Топки" в словаре Брокгауза и Ефрона
Топки
Топки*
или пространство, в котором так сожигается топливо (см. Горючие материалы), чтобы тепло, развивающееся при горении, сообщалось в желаемой мере тем твердым, жидким или газообразным предметам (или пространствам, ими наполненным), которые желательно нагреть выше, чем окружающее пространство, имеют чрезвычайно разнообразное устройство, смотря как по свойству топлива (см., напр., Отопление нефтяное; Генераторный газ и др.), так и по качеству нагреваемого предмета и по температуре, которую ему необходимо сообщить. Обыденные виды топок, или печи (см.), применяемые для нагревании жилищ и для приготовления пищи (кухонные очаги), требуют, например, нагревания до невысоких температур, а при плавке металлов (см., напр., Вагранки, Доменные печи и т. п.), особенно стали, необходим жар или возвышение температуры до очень высокой меры (см. Пирометрия). В печах всегда можно и должно отличать очаг (топливник или Т. в тесном смысле), или место горения топлива, нередко служащий местом передачи тепла (плиты, горны и т. п.), поддувало, или отверстие для входа воздуха, трубу, или место выхода продуктов горения, и стенки, т. е. устройство самой печи. Нагреваемое тело помешается или прямо в смеси с самым топливом (напр., в доменных печах, вагранках и т. п.), или в особых сосудах (тиглях, котлах, муфелях и т. п.) среди горящего топлива и в пламени, им образуемом, или отчасти в пламени, отчасти в дыме (как при нагреве паровых котлов), или, наконец, очаг, дымоходы и стенки печи окружаются нагреваемым телом, напр., в паровиках с внутреннею топкою, в комнатных печах и т. п. Это разнообразится до бесконечности и определяется преимущественно свойствами нагреваемого тела и требуемою температурою. Поэтому описывая, в соответственных местах, разные виды и устройства печей, мы здесь будем касаться самого устройства печей или только в виде типических примеров, или в отношении к таким устройствам, которые прямо или косвенно ведут к экономии топлива. Костер, окруженный с трех сторон кирпичными или металлическими стенками и снабженный дымоотводной трубою, или камин, представляет столь плохой вид пользования почти одною лучистою теплотою горения топлива, что держится еще в практике для нагревания жилищ почти исключительно на основании давней привычки и легкой возможности прямо и просто погреться у огня. Всем известная "русская" печь, где через нижнюю половину очажного отверстия входит воздух, а через верхнюю часть того же отверстия выходит дым, представляет в отношении пользования топливом только ту выгоду, что стенки ее, нагреваемые пламенем, массивны и поглощают много тепла, которое этим путем сохраняется для нагревания жилища и приготовляемой пищи, но все же здесь, как и во всех печах, не допускающих управления притоком воздуха, неизбежный его избыток (происходящий от невозможности полного смешения с продуктами горения) сильно уменьшает полезное действие топлива. То же относится к обычным комнатным печам, действующим лишь периодически и обыкновенно также лишенным возможности хорошо регулировать приток воздуха, а потому действующим обыкновенно при большом его избытке (что всегда неэкономно). В нашем изложении мы коснемся исключительно фабрично-заводских печей, в которых можно управлять доступом воздуха и назначенных для разных случаев продолжительного (более или менее непрерывного) нагревания. Так как расход топлива в таких печах ложится на ценность производимых предметов и нередко образует (напр., при производстве пара, приготовлении стекла, чугуна и т. п.) значительную его долю (напр., при производстве чугуна от 40 до 60 % его заводской стоимости на месте добычи), и так как в большинстве случаев экономия топлива и достижение желаемых температур много зависят от отношения между количеством (в данное время) сгорающего топлива и притекающего к нему воздуха (при избытке его — получаются низкие температуры от увеличения массы дыма, которому передается тепло, а при недостатке воздуха в дыме будут содержаться недогоревшие газы, и топливо не даст всего тепла), то первоначально мы рассмотрим, какое количество воздуха необходимо для полного сожигании топлива, т. е. для превращения всего углерода, в нем содержащегося, в углекислый газ, СО 2, и всего водорода в воду, Н 2 О. Зная состав топлива, можно легко вычислить количество воздуха, необходимого для его полного сожигания, так как вес куб. меры воздуха [Вес воздуха. Заметив, что 1 куб. сажень = 9,713 куб. метрам или 9713 литрам и 1 куб. фут = 28,3, что пуд = 16380 граммам, а фунт (русский) = 409,5 г, мы делаем весь дальнейший расчет на куб. метр в граммах по той причине, что в метрических мерах выражаются все точные определения, относящиеся до воздуха. Лучшие опыты дают, что, в зависимости от напряжения тяжести (g в метрах), вес одного куб. метра сухого воздуха, лишенного углекислоты, при 0° и при нормальном давлении, равном 760 миллиметрам (ртутного барометрического столба при 0°), равен 131,84. g граммов. А так как g для Петербурга = 9,8188 м, и в России изменяется примерно от 9,80 до 9,82, то можно принять с точностью до 2/10 %, что куб. метр (= 1000 литров с точностью до 1/100 %) норм. воздуха в России весит 181,84. 9,81 или 1293,35 грамма. От содержания углекислого газа, объемное количество которого в свободном воздухе изменяется от 0,028 до 0,032 % (среднее 0,03 %), вес куб. метра норм. сухого воздуха возрастает (так как плотность (О 2, по воздуху, = 1,52) до Е 0 = 1293 грамма. (± 2 г; более точный расчет требует знания g, но в заводской практике не может требоваться большей точности). Влажность воздуха, изменение его температуры (градусы Цельсия) и перемены барометрического давления изменяют этот вес в значительной мере, а именно, если упругость водяных паров означим h (миллиметров ртутного столба), если плотность (по воздуху) водяных паров примем = 0,63, если температуру воздуха означим t ° С, и если коэффициент его расширения на 1° С примем = 0,00367, а общее давление (высоту ртути в барометре при 0°) означим через H мм (при 0°), то в этих условиях вес куб. метра воздуха:
Е = Е 0[(H — 0,37h) / 760(1 + 0,00367t)] граммов.
Что касается до h (упругость вод. паров воздуха), то она = hm Р/100 , где hm означает наибольшую возможную при t упругость (насыщенных) паров, а Р процентное содержание влажности (наблюдаемое на гигрометре или определяемое психрометрами, см.). Это последнее можно принять вообще для России = 70 % (только в сухих степях и особых условиях сухости оно вообще ниже; при 70 % влаги точки росы, примерно, на 5° ниже t воздуха), а потому можно принять
| t | —15° | —10° | —5° | 0° | +5° | 10° | 15° | 20° | 25° | 30° C. |
| hm = | 1,4 | 2,2 | 3,2 | 4,6 | 6,5 | 9,1 | 12,7 | 17,4 | 23,5 | 31,5 мм. |
| h = | 1,0 | 1,5 | 2,2 | 3,2 | 4,6 | 6,4 | 8,2 | 12,2 | 16,5 | 22,1 " |
На основании этого, для примера, разочтена следующая таблица (Е вес куб. метра воздуха в граммах):
| H = | 720 | 740 | 760 | 780 мм | |
| t = —15°C | Е = | 1297 | 1333 | 1370 | 1406 г |
| = 0° " | 1223 | 1257 | 1291 | 1325 | " |
| = +15° " | 1155 | 1187 | 1219 | 1251 | " |
| = 30° " | 1091 | 1132 | 1162 | 1193 | " |
Для технических расчетов в большинстве случаев можно принять, что вес куб. м воздуха равен:
Е 1 = 1208 + 5(15 — t) + 2(H — 750) г,
потому что погрешность этой приближенной и простой формулы в обычных условиях составляет лишь десятые доли % всего веса. Пусть напр. дано, что H = 750,0 мм, h = 6,0 мм, t = 10° С, точное значение Е = 1227 г, а приближенное: E1 = 1233 г.] и его весовой и объемный состав известны, если известны температура, влажность и давление, относящиеся к воздуху. Очевидно, что все дело здесь в количестве требуемого кислорода. Если в 100 г топлива содержится с г углерода, то для полного превращения их в углекислый газ требуется с 32/12 или c22/3 г кислорода, на h г водорода надо h8 г кисл. и на s г серы s г кислорода, всего на 100 г топлива, содержащего о гр. кислорода, требуется K = c22/3 + h8 + s + o г кислорода. Если на основании метеорологических данных для воздуха известно, что в одном куб. метре его содержится q г кислорода [Состав воздуха. Когда свободный атмосферный воздух лишен углекислоты и воды, его состав одинаков; в нем содержится всегда 20,9 объемных процентов кислорода и 78,3 % по объему азота и ок. 0,8 % по объему аргона (и сходных с ним криптона, неона и др.), плотность которого почти в 1 1/2 раза более плотности азота. А так как, приняв вес одного объема водорода = 1, плотность кислорода = 16, азота = 14 и аргона = 21, то весовой процентный состав воздуха (без СО 2 и H 2 O) следующий:
| Кислорода | 20,9 x 16 = 334,4 | или 23,10 по весу. |
| Азота | 78,3 x 14 = 1096,2 | 75,74 " " |
| Аргона | 0,8 x 21 = 16,8 | 1,16 " " |
| 1447,4 | 100,00 |
Что же касается до воздуха обыкновенного, т. е. содержащего углекислоту и водяные пары, то его объемный и весовой состав найдутся, если заметим, что (см. предш. выноску) общее давление = Н мм, а упругость водяного пара = h мм. Отсюда следует, что объем сухого воздуха относится к объему водяных паров, как H — h относится к h. Следовательно, в 1 куб. м влажного воздуха содержится 1 — h/H куб. м сухого воздуха и h/H. куб. м водяных паров (напр., при 70 % влажности и 30°, при 760 мм давления в куб. метре воздуха 22,1 /H или ок. 3 % по объему водяного пара). Что касается до углекислого газа, то его объем должно в среднем принять = 0,03 на 100 об. сухого воздуха. Пусть, напр., дано, что H = 750, t = 15°, h = 10, состав 100 объемов воздуха будет: водяного пара 100.10/750 = 1,33 об., а сухого воздуха 100.740/750 = 98,67 об., а в этих 98,67 об. будет содержаться 0,03.0,9867 = 0.0296 или почти 0,03 об. углекислого газа, кислорода 20,9.0,9864 = 20,63 об., азота 78,3.0,9864 = 77,23 об. и аргона 0,8.0,9864 = 0,79 об. Эти числа дают содержание составных начал воздуха — по объему, но для расчетов при топливе, количество которого определяется весом, необходимо определить весовое содержание кислорода в одном объеме воздуха, так как количество воздуха может измеряться только объемами. Вопрос немного усложняется тем, что объем воздуха изменяется с содержанием водяных паров, температурою и давлением. Если (см. предш. выноску) куб. метр сухого воздуха весит 1293 г при 0° и 760 мм давления, то в тех же условиях вес куб. метра кислорода = 1429 г, а водяного пара = 814 г. Очевидно, что в 1 куб. м влажного воздуха, при t и H, сухого воздуха по объему будет 1 — h/H куб. м, а кислорода будет 0,209(1 — h/H) куб. м., след., вес кислорода (граммы) q, содержащегося в 1 куб. м воздуха, будет:
| q = | (1429.0,209[H — h]) /([1 + 0,00367]760) = 298,66. A |
| азота | = 978,75. А |
| аргона | = 15,00. А |
| углек. газа | = 0,59. А |
| вод. пара | = 814. (h/[H — h]). А |
Сумма Ε = [1293(H — 0,37h)]/([1 + α t]760)
где А = (H — h)/([1 + α t]760)
Так, напр., если (как выше) H = 750, t = 15, h = 10; в куб. метре воздуха будет содержаться (А = 0,9218)
| Кислорода | 275,3 грамма | = 22,90 % по весу. |
| Азота | 902,3 " | = 75,06 " " " |
| Аргона | 13,8 " | = 1,15 " " " |
| Углкисл. | 0,6 " | = 0,05 " " " |
| Вод. паров | 10,1 " | = 0,84 " " " |
| Воздух | 1202 г | 100,00 |
В прилагаемой таблице дано содержание q граммов кислорода в 1 куб. м воздуха, вес которого дан в предшествующей выноске:
| h | t | H = 720 | 740 | 760 | 780 мм. | % по весу |
| 1,0 мм | —15° C | q = 299 | 308 | 316 | 324 грамм | 23,1 |
| 3,2 | 0° C | 282 | 290 | 297 | 305 " | 23,0 |
| 8,2 | +15° C | 265 | 272 | 280 | 287 " | 22,9 |
| 22,1 | +30° C | 247 | 254 | 261 | 268 " | 22,6 |
Приближенно можно принимать, что в 1 куб. м воздуха содержание кислорода
q = 276 + 1,2 (15 — t) + 0,6 (H — 750) г.
Когда метеорологические данные не наблюдены, можно принимать вообще, что кислорода по весу 23 %, а в куб. метре содержится ок. 250—300 г кислорода.], то для сожигания 100 г топлива, очевидно, требуется V = K/q куб. м воздуха. Пусть, напр., дана нефть, с = 86, h = 14; на 100 г ее требуется K = 341,3 г кислорода и пусть дано давление воздуха 750 мм, его темП., 10°, влажность 70 %, откуда находим, куб. м воздуха весит 1227 г и содержит q = 228 г кислорода, а отсюда очевидно, что для полного сожигания 100 г взятой нефти требуется 341,3/282 или 1,21 куб. м воздуха [Следовательно, на 1 кг нефти 14,8 кг или 12,1 куб. м воздуха, или на 1 пд. нефти 14,8 пд., или 19,3 куб. саж., или 6620 куб. фт. воздуха. Для приближенных расчетов, найдя количество К кислорода в граммах, можно принимать вес требуемого воздуха = K. 4,35 г, а объем равен K. 4,35/E1 куб. м, где E1 есть вес куб. метра воздуха, определяемый как в [1]. Если же температура и давление воздуха неизвестны, то можно в первом приближении считать объем необходимого воздуха, принимая, что в 1 куб. м воздуха содержится 290 г кислорода, а в 100 частях воздуха по весу 23 весовых частей кислорода. Во всяком случае, главный элемент, определяющий объем воздуха, необходимого для горения, есть К (вес необходимого кислорода), a по составу топлива его легко получить.] Суждение о количестве воздуха, действительно притекающего к топливу, производится или 1) через измерение скорости этого притока (с помощью анемометров разного устройства) и поперечного сечения того отверстия (поддувало), через которое поступает воздух в Т., где измеряется количество топлива, сгоревшего в единицу времени, или 2) через исследование состава дыма, когда известна масса сгорающего топлива и его состав. Последний способ проще и достовернее, потому что отбирая малые доли дыма, можно судить об общем среднем более достоверно, даже тогда, когда забрасывание топлива производится при помощи периодического открывания дверец очага, причем врывается воздух помимо поддувала. Если горение полно, одно определение в дыме свободного кислорода и образовавшейся углекислоты (что производится легко, скоро и точно) дает уже количество притекающего воздуха, когда состав топлива известен. При неполном горении (образовании сажи, окиси углерода и т. п.) требуется ужо определение в дыме, сверх кислорода, и СО 2, количества продуктов неполного горения, что уже усложняет вывод, но все же он и тогда точнее, чем при определении скорости воздуха в поддувале. Для нефти, превращенной в мельчайшие капли при помощи пульверизации паром (форсункою, см.) или струею воздуха, можно достигнуть полного горения с таким количеством воздуха, которое лишь немного превосходит предшествующий расчет. Для пылевидного твердого топлива также. Для газообразных видов топлива еще точнее можно достичь полного горения при притоке лишь строго необходимого количества воздуха. Но для дров, каменного угля и торфа, сожигаемых в обычных печах, нельзя достичь полноты смешения горючих продуктов их разложения с воздухом, а потому количество расходуемого воздуха на 30, даже 60 процентов, а обыкновенно (и даже очень нередко) в два и более раза превосходит необходимость, что ведет не только к понижению температуры, доставляемой топливом, но и к уменьшению всего его полезного действия. Поэтому то превращение твердого топлива в тонкий порошок или в горючие газы, несмотря на сопряженные с этим накладные расходы, часто оказывается в практике весьма целесообразным и выгодным, особенно если требуются высокие температуры. Если же к топливу, хотя бы раздробленному или превращенному в горючие газы, притекает в очаге (Т.) менее воздуха, чем следует для полного горения, то вместе с продуктами горения удаляется часть недогоревших веществ (особенно сажа, окись углерода и ацетилен), а это не только ведет к напрасной потере топлива и образованию дыма (он происходит также и при избытке воздуха от недостаточной температуры некоторых частей пламени, если нет совершенного перемешивания или происходит быстрое охлаждение), но и понижает температуру очага. Итак, вреден и недостаток, и избыток воздуха. Это указывает на трудность достижения наивыгоднейшего пользования топливом. Оно достигается только тогда, когда есть лишь ничтожный избыток воздуха, узнаваемый из того, что в продуктах горения (дыме) нет или содержится очень мало свободного кислорода воздуха и вовсе нет горючих газов. А это условие практически вполне достижимо только при употреблении газообразных видов топлива, вследствие чего они за последнее время находят все большее и большее техническое приложение. Но во всяком случае уже лучше иметь избыток воздуха (как это и встречается всегда в обычных домашних и заводских печах), чем его недостаток, потому что при этом все же может достигаться полное горение [Для сознательного отношения к применению топлива немалое значение имеет сверх того определение состава и количества продуктов горения или дыма. Опытное исследование этого предмета основывается на анализе и определении температуры дымовых газов, потому что тогда, зная состав и расход топлива, можно уже судить о количестве (весовом и объемном) притекающего к топливу воздуха. Определение температуры дыма не представляет трудностей, так как она невысока, обыкновенно не выше 300°, редко до 350°, a, такие темп. прямо измеряются соответственным (имеющим длинную трубку между шариком терм. и его шкалою) ртутным термометром, погружаемым (через особое отверстие в стенке дым. трубы) в дым около того места в самом начале трубы, где отбирается часть дыма, назначаемая для определения его состава. Хотя состав дыма, в сущности, очень сложен (см. Газовый анализ), но в нем особо важно определение относительных количеств углекислого газа (СО 2), окиси углерода (СО, находимой только при условиях неполного горения), свободного кислорода, азота и водяного пара; обыкновенно же довольствуются определением СО 2, СО, кислорода и азота. Для скорого и довольно точного определения содержания этих газов, достаточно: измеренный (при данных давлении и обыкн. темпер.) объем собранного дымового газа привести в прикосновение с раствором едкого натра, поглощающим углекислый газ (СО 2), измерить объем остатка, а в нем определить кислород (щелочным раствором пирогаллина) и окись углерода (солянокислым раствором полухлористой меди), измеряя каждый раз остаток и, следовательно, определяя соответственный объем поглощенной части (угл. газа, окиси углер. и кислор.) и остаток азота. Если найден объемный состав средней пробы охлажденного дымового газа, простое вычисление дает его весовой состав, след., и весовое содержание углерода и свободного кислорода. По содержанию углерода в топливе (в воздухе же чересчур мало СО 2, чтобы и это принимать в расчет) и дыме получается отношение между количеством сгоревшего топлива и объемом воздуха. По содержанию воды водорода в топливе определяется влево количество водяных паров в дыме, а объем пара находится по температуре, найденной для дыма.]. При неполном горении, вместо углекислого газа СО 2 получается окись углерода СО, которая легче углекислого газа, а при избытке воздуха остается кислород, который также легче углекислого газа, следовательно, полное горение определяется для данного вида топлива — наибольшею (при данной температуре и том же давлении) плотностью дыма, высушенного помощью веществ, отнимающих влажность.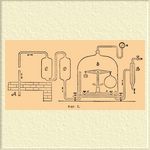
Фиг. 1.
Поэтому в заводской практике об экономическом пользовании данным топливом и данною печью (т. е. об наиболее соответственном отношении между количеством сгорающего воздуха и притекающего топлива) можно просто и прямо судить по изменению плотности сухого и охлажденного дыма; если, например, при той же засыпи топлива уменьшение поддувала или вообще отверстия (заслонки, задвижки, клапана), определяющего приток воздуха, ведет к тому, что дым становится тяжелее, утилизация топлива увеличивается, если же охлажденный дым становится тогда легче, — необходимо увеличить доступ воздуха, чтобы достичь более полного сожигания. Приборы, служащие для удобного (наглядного) определения изменения плотности дыма, получили название дазиметров или эконометров. Так как плотность углекислого газа (22, если H = 1) примерно в 1 1/2 раза более плотности воздуха (14,4), азота (14) и кислорода (16), то, по мере улучшения горения и возрастания в дыме содержания углекислого газа, плотность охлажденного дыма (при постоянной, напр., комнатной, температуре) возрастает, и по ней можно судить о % СО 2 и об изменениях в процессе горения в очаге. Если представим, что большой и легкий шар взвешивается в атмосфере охлажденного дыма, то кажущийся вес шара, равный его истинному весу без веса вытесненного объема атмосферы, будет убывать по мере прибыли СО 2 в дыме. На этом начале и устроены довольно уже разнообразные дазиметры и эконометры, помещаемые около самой топки и определяющие плотность охлажденного дыма во время самого хода горения. Для этой цели из дымохода А водяным насосом непрерывно вытягивается некоторая часть дыма. Проходя через цилиндры С и D, наполненные ватой и помещенные в сосуд с водою, имеющею обыкн. температуру, дым оставляет в них частицы сажи и главную часть воды и входит под стеклянный колокол или шкаф E, в котором находятся весы, назначенные для определения плотности дыма, а именно объемного процента углекислого газа, так что и деления шкалы весов прямо наносятся пропорционально объемному проценту углекислого газа, а нуль шкалы отвечает положению равновесия в воздухе [Чтобы показать явное изменение в плотности дыма по мере увеличения содержания СО 2, достаточно указать на то, что если объем взвешиваемого шара = = 500 куб. см, и при давлении 760 мм температура пространства = 20° С, то в чистом воздухе потеря веса будет около 602 миллиграммов, а в воздухе, содержащем 10 % СО 2 по объему, около 633 мг, т. е. на каждый % вес сосуда будет изменяться примерно на 3 миллиграмма, а такое изменение веса может быть отлично и ясно видимо при надлежащей чувствительности правильно устроенных весов, которые могут прямо по деленной шкале показать объемный % углекислоты. Эконометры представляют по существу такое же устройство, как и дазиметры, только определяется не потеря веса пустотелого шара, а вес газа, вмещающегося в опрокинутый цилиндр, подвешенный на весах и снабженный трубкою, через которую входит и постоянно возобновляется дымовой газ. Считаю нелишним заметить, что показания подобных приборов по многим причинам не могут отличаться очень большою точностью, но не в ней здесь и дело, а относительную прибыль или убыль в дыме СО 2 они показывают с ясностью, что и дает возможность рационально улучшать топки.]. Ссылаясь на указанное выше описание специального устройства разнообразнейших Т. (см. также Паровые котлы), мы ограничимся далее лишь общими замечаниями о Т. и некоторыми расчетами, до них относящимися. Горящее в печи топливо передает развиваемое тепло как нагреваемому телу В, так и окружающим стенам печи С и дыму D, а потому первую задачу в устройстве печей в большинстве случаев составляет уменьшение долей С и D, так как по существу дела желательна лишь передача В. Для уменьшения доли С везде, где возможно, самое сожигание ведут внутри нагреваемого тела, т. е. очаг устраивают в нем самом. Таковы, напр., обыкновенные домашние печи, паровики с внутреннею топкою, обыкновенные самовары и т. п. Способ этот, однако, может быть с выгодою прямо применяем только при нагревании жидкостей и газов, но не твердых тел, и часто имеет лишь небольшое экономическое значение, потому что в прерывно действующих печах при достаточной толщине стенок, из столь плохих проводников тепла, как кирпич и глина, потеря тепла через них обыкновенно не превосходит лишь нескольких (5 — 8) процентов, и обыкновенно гораздо меньше потери тепла D в дыме. Очевидно, что при прочих равных условиях, потеря через стенки печи будет тем меньше, чем больше может быть разность температур внутренней и внешней поверхностей этих стенок (т. е. чем менее теплопроводен их материал при данной толщине, а при данном материале — чем толще стенка), и что для удовлетворения этому условно, полезнее всего окружить печь двойною стенкою, с запертым воздушным промежутком, т. е. прибегнуть к тому же средству, которое применяется при устройстве двойных зимних рам, так как из опыта известно, что не сменяющийся замкнутый слой воздуха весьма худой проводник тепла. Но и помимо этого, устройство печных стенок из глины и кирпича, как очень дурных проводников тепла, при достаточной толщине обеспечивает малую потерю тепла, развиваемого топливом в очагах. Опыт показывает, напр., что в доменных печах, внутри которых температура достигает обыкновенно до белого каления и все время, по возможности, держится равномерно высокою, потеря через стенки не превосходит 5, много 10 % всего тепла, доставляемого печи горением и вдуванием нагретого воздуха, а при подробном разборе (Friderici 1882, Ledebur) одной домны (Vordenberg, n 0 2), работающей на древесном угле (3/4 угля на 1 часть чугуна), оказалось, что при введении в печь 2726 ед. тепла, потребляемых для выплавки 1 части чугуна, вся потеря тепла на лучеиспускание через стенки не превосходила 49 ед. тепла, т. е. составила менее 2 %. Конечно, и такие потери тепла имеют свое значение, но здесь, как и в большинстве других случаев, утолщение стен печи или устройство двойной стенки (с замкнутым воздухом), хотя без сомнения уменьшают потерю через лучеиспускание, но настолько удорожают устройство и затрудняют ремонт (поправку), что выгоды в топливе не покрывают этих неудобств, как видно из того, например, что прежние (до 1850—1860 гг.) доменные печи всегда делались с очень массивными стенками, новейшие же делают с гораздо менее массивными стенками, скрепляемыми кольцами, предпочитая терять около 10 — 12 % тепла через стенки, охлаждающиеся обтекающим воздухом, лишь бы облегчить все сооружение и сделать все его части доступными для починки при случайных повреждениях. Что же касается до потерь тепла в дыме С, то они прежде и более всего зависят от той температуры, до которой нагревается тело В, так как дым, очевидно, должен иметь температуру не меньшую, чем нагреваемое тело, и если эта последняя высока (напр., в стеклоделии и в большинстве металлургических производств), то в дыме может уходить очень много тепла, развиваемого топливом. В подобных случаях, очень частых в практике, прибегают, ради экономического пользования топливом, к трем способам: 1) им на выходящем из Т. дыме (или пламени) нагревают какие-либо иные предметы, напр., воду в паровых котлах, сушат топливо (напр., дрова, чтобы они давали более тепла и высокую температуру), нагревают воздух (проходящий по трубам) для отопления и т. п.; или 2) ведут, по возможности, непрерывное нагревание и накаленным дымом предварительно подогревают нагреваемое тело, притом так, чтобы дым шел навстречу вводимому для нагревания веществу и выходил там, где холодное вещество вводится в печь, примером чему могут служить круговые печи для обжигания кирпича (см. Кирпичное производство), напр., печь Гофмана; или же 3) высокою температурою дыма пользуются для предварительного подогревания воздуха (а иногда и горючего газа, если им производят Т.), идущего для горения топлива в ту же печь, так как чем более накален входящий в печь воздух, тем высшую температуру дает он при горении и, следовательно, тем менее расходуется топливо. Так устроены регенеративные и рекуператорные Т. (см. Генераторный газ; Литая сталь). Во всех этих приемах, равно как и в обычных печах и Т., где нагреваемое тело имеет невысокую температуру, дым все же уходит нагретый, и в нем уносится некоторое количество тепла, развиваемое топливом. Это неизбежно по трем причинам. Во-первых, потому что всякая передача Т. совершается тем медленнее, чем менее разность температуры горючего и нагреваемого тел, а потому полное охлаждение дыма (с передачей его тепла нагреваемым предметам) может быть без громадных сооружений доведено только до некоторой границы, превышающей окружающую температуру. Во-вторых, дым — для правильности тяги воздуха в печи — должен иметь в дымовой трубе меньшую плотность, чем внешний воздух, потому что на этой разности плотностей основано все действие дымовых труб, а сохраняя повышенную температуру, дым и представляет (от расширения) меньшую плотность. В-третьих, в дыме, при обычном топливе, содержащем воду топлива и происшедшую от горения водородистых его составных частей, содержится много водяных паров, и если бы дым охладился ниже 100° С, он выделил бы капельножидкую воду, которая не только загрязнила бы дымоход, но и сделала бы дым (от содержания СО 2) более тяжелым, чем воздух, взятый при той же температуре.
На основании сказанного, дым в лучшем случае должен быть нагрет до температуры выше 100°. Обыкновенно его температура не спускается ниже 150° С, и было бы уже не экономно, если бы она была выше 250°, хотя иногда неэкономные заводчики допускают уходить дым в 350°, теряя через то около 10 % топлива даром. Чтобы получить ясное представление о потерях тепла в дыме, мы сделаем расчет в предположении температуры уходящего дыма в 150° и в 250° С при употреблении, как топлива, каменного угля, содержащего в килограмме: углерода 800 граммов, водорода — 50 г, кислорода — 80 г, золы, азота и проч. — 70 г.
Если горение будет полное, то из 800 г углерода получится 2933 г углекислого газа СО 2, а из 50 г водорода 450 г воды Н 2 О, то есть присоединится 2133 + 400 или 2533 г кислорода. Но так как в угле было 80 г кислорода, то из воздуха вступит в соединение с углеродом и водородом 2453 г кислорода. Приняв (а это близко к действительности, см. выше), что в килограмме воздуха содержится 230 г кислорода, получим, что для полного горения 1 кг каменного угля надобно впустить в печь никак не менее 10665 г воздуха. Но в обычных, даже очень хорошо устроенных и хорошо руководимых топках для каменного угля (не говоря о топках для нефти или для газового или пылевидного топлива) необходимо вводить примерно в 1 1/2 раза более воздуха, чем следует по составу, так как иначе горение не будет полным и живым; а потому должно принять, что на 1 кг взятого каменного угля пойдет около 15 кг воздуха и получится около 16 кг дыма. Теплоемкость дыма, содержащего много водяных паров, близка к 0,27, а потому от 0° до 150° в каждом килограмме дыма будет содержаться около 40 килограммовых единиц тепла [То есть килограмм дыма, передав воде, имеющей температуру 15° С, все свое тепло, нагреет 40 ее кг до 16° С, если принять теплоемкость воды за единицу при 15 С.], а в 16 кг дыма 640 единиц тепла, если же дым нагрет до 250°, то 1066 единиц тепла. Если теперь узнать сколько килограммных единиц тепла Q развивает (при полном горении) взятый каменный уголь, то легко уже будет узнать потерю тепла в дыме, имеющем 150° или 250°. Количество тепла, развиваемое топливом, узнаем очень близко по формуле [Д. Менделеев, "Основы фабр.-завод. промышл. Вып. I. Топливо". 1897 г., стр. 90.] Q = 81c + 300h — 2 6(o — s), в которой Q означает количество килограммовых единиц тепла (больших калорий), развивающихся при полном горении (т. е. до СО 2, Н 2 О и SO 2) углеродистого твердого или жидкого топлива, содержащего с процентов (по весу) углерода, h водорода, о кислорода и s процентов серы, если вся происходящая при горении вода получается в жидком виде. Поэтому для взятого в расчет каменн. угля
Q = 81 (80) + 300 (5) — 26 (8) = 7772 ед. тепла.
Но в дыме вода содержится не в жидком виде, а в парах, каждая же весовая часть воды, превращаясь в пар, расходует около 600 единиц тепла, а потому 1 кг каменн. угля, производя при горении дым, содержащий происходящие 0,45 кг воды (= 450 граммов), разовьет не 7772 единиц тепла, а меньшее количество на 0,45.600 или на 270 единиц тепла, следовательно, взятый килограмм угля дает при полном сгорании
Q' = 7772—270 = 7502 ед. тепла.
Выше же мы показали, что в дыме, нагретом до 150°, уносится 640, а в дыме при 250° — до 1066 ед. тепла, а потому при взятых условиях в дыме теряется около 71/2 % тепла, если дым имеет температуру в 150° С и около 141/4 %, если дым выпускается со среднею температурою в 250° С. При топливе, богатом влагою (напр., дрова, торф), процент потери тепла возрастает, но вообще потерю тепла в дыме должно принимать от 10 до 20 % сравнительно с тем теплом (Q'), которое развивало бы топливо, если бы всю образующуюся воду считать в парах.
При этом необходимо заметить, что в заводской практике во многих отношениях (особенно вследствие частого применении паровых котлов) удобнее всего выражать качество топлива количеством воды, испаряемой при сожигании одной весовой части топлива, тем более, что опыты подобного рода могут быть всюду произведены гораздо легче, чем калориметрические определения. Соответственные числа даны в последнем столбце таблицы, в том предположении, что вода взята при 0°, и из нее получился пар при 100° (если эти условия изменены, то надо сделать поправку. [Так, напр., для превращения воды, имеющей 0°, в пар, имеющий Т°, можно принять, что расходуется единиц тепла L:
| Т = 100° | 150° | 200° |
| L = 640 | 667 | 702 |
и вообще в пределе опытной точности (которая здесь не более 1° С):
L = 640 + 0,6(T — 100).
Если же взятая вода имеет не 0°, а температуру t, то, судя по
| "БРОКГАУЗ И ЕФРОН" >> "Т" >> "ТО" >> "ТОП" |
Статья про "Топки" в словаре Брокгауза и Ефрона была прочитана 1158 раз
| Коптим скумбрию в коробке |
| Салат тофу |
TOP 15
- Волос
- Проно
- Степные животные
- Гимнастика
- Индийский океан
- Архитектура
- Сравнение, в литературе
- Манда
- Клитры
- Колесование
- Испарение
- Травоядные животные
- Оплодотворение у pacтений
- Вредные насекомые
- Электризация тел