


БНБ
"БРОКГАУЗ И ЕФРОН" (121188)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Предельные органические кислоты
Определение "Предельные органические кислоты" в словаре Брокгауза и Ефрона
Предельные органические кислоты
Предельные органические кислоты*
(хим.) — П. органические кислоты можно рассматривать как продукты замещения водородных атомов предельных углеводородов (см. Парафины) карбоксильными группами (см. Кислоты). Смотря по числу последних различают кислоты П. одноосновные, общей формулы C nH2n+1CO2 H (кислоты жирные по преимуществу; см.), и кислоты П. многоосновные, общей формулы C nH2n+2-m—(CO2H)m; как в тех, так и в других в углеводородных остатках C nH2n+1 и C nH2n+2-m один или несколько атомов водорода могут быть замещены: гидроксилами (см.), при чем получаются оксикислоты (см. ниже), или амидогруппами (NH 2)', при чем образуются амидокислоты или глицины (см. Гликоколь), или нитрогруппами (NO 2)' и т. д.
Кислоты П. одноосновные (и одноатомные) образуются с сохранением числа углеродных атомов в частице: 1) при окислении первичных [Известен случай образования (небольш. количество) П. кислоты и при окислении третичного спирта: (CH 3)3C(OH) + O2 (триметилкарбинол) = (CH 3)2—CH—CO2H + H2 O (изомасляная кислота) (Бутлеров).] П. спиртов и альдегидов: 2CH 3—CH2(OH) + O2 = 2CH3—CH(OH)2 [Гликоль такого строения гипотетичен и никем пока получен не был, но эфирные производные, ему отвечающие (ацетали), при окислении спиртов образуются.]; 2CH 3—CH(OH)2 — 2H2O = 2CH3 —COH (альдегид) и 2CH 3—COH + O2 = 2CH3 —COOH (кислота уксусная); реакция рассматривается обыкновенно как последовательное окисление водородных атомов того углеродного атома, с которым уже был ранее соединен кислородный атом; окисление ведут, действуя на спирт (альдегид) смесью двухромовокалиевой соли с серной кислотой; спирты с большой частицей могут давать П. кислоты (Ca и Na соли) при нагревании с натристой известью (Дюма и Стас, Гелль):
C15H31—CH2 (OH) (эталь) + NaOH = C 15H31—CO2 Na (пальмитиновая соль; см.) + 2H 2;
2) при действии водорода in st. nasc. на непредельные кислоты:
CH2=C(CH3)—CO2 H (метакриловая кислота, см. Кротоновая кислота) + H 2 = (CH3)2—CH—CO2 H (изомасляная кислота; Фиттиг и Пауль),
а равным образом на галоидозамещенные П. кислоты:
CCl3—CO2 H (трихлоруксусная кислота) + 3H 2 = CH3—CO2 H (уксусная кислота) + 3HCl (Мельсанс)
и на П. оксикислоты:
CH3—CH(OH)—CO2 H (молочная кислота; см.) + 2HI = CH 3—CH2—CO2H + I + H2O,
а так как оксикислоты могут быть получены из кетонокислот (см.), глицинов (см. выше) и из нитрокислот (через глицины), то, следовательно, П. кислоты могут быть получены и из всех этих соединений; П. кислоты образуются еще: 3) "омылением" (см.) соответственных нитрилов (см.):
HCN (цианистый водород) + 2H 2O = H2CO2 (муравьиная кислота) + NH 3 или H 3C—CN + 2H2O = CH3—CO2H + NH3 (Кольбе и Франкланд).
Синтетическими реакциями образования П. кислот являются: 4) действие углекислого газа на натрийорганические соединения (Ванклин): CH 3Na + CO2 = CH3—CO2 Na (см.); 5) действие окиси углерода (при 160°—200°) на алкоголяты натрия (Гейтер, Пётч): CH 3—CH2(ONa) + CO = CH3—CH2—CO2 Na, реакция, отвечающая образованию муравьиной соли при действии окиси углерода (при 100° Ц.) на раствор едкой щелочи (Бертело): CO + KOH = HCO 2 K, окиси же углерода (при 200° Ц.) на натристую известь (Мерц и Тибирица) [Реакция предложена как техническая. Реакция CO с алкоголятами высших спиртов идет очень негладко (Пётч).]; 6) действие хлорокиси углерода на цинкорганические соединения (Бутлеров): Zn(CH 3)2 + 2COCl2 = 2CH3—COCl + ZnCl2 и 2CH 3—COCl + 2H2O = 2CH3—COOH + 2HCl; [Условия этой реакции в точности не известны; А. М. Бутлерову только раз, при получении триметилкарбинола из COCl 2 и Zn(CH 3)2, удалось наблюдать образование CH 3—CO2 H.]; 7) электролиз раствора смеси калиевых солей П. одноосновной кислоты и П. двухосновной эфирной кислоты (Миллер и Гоффер):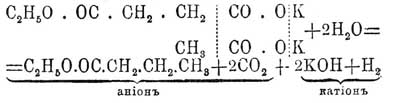
П. одноосновные кислоты являются продуктами распадения: 8) одно- и двузамещенных ацетоуксусных эфиров под влиянием концентрированной спиртовой щелочи (Франкланд и Дюппа, И. Вислиценус):
CH3—CO—CHR—CO2C2H5 + 2KOH = CH3—CO2K + CH2R—CO2K + C2H5 (OH) и
CH3—CO—CR2CO2C2H5 + 2KOH = CH3—CO2K + CHR2—CO2K + C2H5(OH);
9) одно- и двузамещенных малоновых кислот (см.) при нагревании (Конрад):
HO2C—CHR—CO2H = CO2 + HO2C—CH2 R и HO 2C—CR2—CO2H = CO2 + HO2C—CHR2;
10) бариевых солей двухосновных кислот при нагревании с метилатом натрия (Май; ср. Парафины):
HO2C—CH2—CH2—CO2H = CO2 + HO2C—CH2—CH3
или свободных кислот под влиянием солнечного света в присутствии урановых солей (Зеекамп):
HO2C—CH2—CH2—CO2H = CO2 + HO2C—CH2—CH3;
11) непредельных кислот этиленного ряда при плавлении с едким кали (Варрентрапп, Гейтер, Марассе, Кекуле, Фиттиг):
CH3—CH=CH—CO2H + 2KOH = CH3—CO2K + CH3—CO2K + H2;
12) П. кетонов при окислении их двухромовокалиевой солью с серной кислотой (Попов, Вагнер):
2CH3—CO—CH3 + 3O2 = 2CH3—CO2H + 2H—CO2H;
13) П. кетонов же, переходя через оксимы (Бекманн, В. Мейер и Уоррингтон; ср. Кетоны):
(СР 3)2—CH—C(N—OH)—CH—(CH3)2 = (CH3)2—CH—CO—NH—CH—(CH3)2 и
(CH3)2—CH—CO—NH—CH—(CH3)2 + HOH = (CH3)2—CH—CO(OH) + H2N—CH—(CH3)2
и 14) некоторых олефинов (см.) при окислении; так, например, триметилуксусная кислота (CH 3)3C—CO2 H получена Бутлеровым при окислении диизобутилена C 8H16 и триизобутилена C 12H24. Из перечисленных реакций для получения кислот 1, 3 и 9 идут наиболее гладко и потому чаще других применяются. Некоторые П. одноосновные кислоты встречаются в свободном состоянии в природе (см., например, Муравьиная кислота) и очень многие в виде эфиров глицерина, входя в состав жиров (см.) и масел (см.); уксусная кислота (см.) образуется при брожении спирта обыкновенного, а нормальная масляная и каприловая при брожении молочнокислого кальция (маслянокислое брожение; см.). Низшие члены предельных кислот при обыкновенной температуре (+20° Ц.) жидки; начиная с каприловой кислоты CH 3—(CH2)8—CO2 H (плавится при 31,4°), они тверды; правильности в точках плавления подмечены только для кислот нормального ряда, т. е. содержащих только одну метильную группу, соединенную с карбоксилом через посредство цепи групп (CH 2)', а именно В. Мейер и Якобсон (1893) и Массоль (1896) указали, что они расположены на двух кривых (фиг. 1); верхняя отвечает точкам плавления кислот с четным числом атомов углерода, а нижняя — с нечетным (ср. Парафины); кислотам, содержащим C 4 и С 5, отвечают в обеих кривых минимумы; начиная с C 6 и C 7 кривые идут почти параллельно до C 18 и C 19; выше замечается некоторая неправильность, но температуры плавления высших кислот нельзя считать достоверно установленными. [По Мари, церотиновая кислота содержит не C 27, a C25; в таком случае ее точка плавления наблюдена вполне правильно.]
Фиг. 1.
Кислоты другого строения имеют иногда гораздо высшие точки плавления; так триметилуксусная кислота (Бутлеров) (CH 3)3 С—CO 2 H плавится при +36,4°, т. е. на 93,9° выше нормальной валериановой — CH 3—(CH2)3—CO2 H. [Вообще вещества, содержащие много метильных групп, обладают более высокими точками плавления и более низкими точками кипения; ср. свойства триметилкарбинола (см.) со свойствами бутиловых спиртов и свойства тетраметилбутана (см. Парафины) со свойствами изомерного с ним нормального октана.] Точки кипения П. нормальных кислот повышаются приблизительно на 19° с увеличением веса частицы на гомологическую разность CH 2; для кислот от C 1 до C 6 разность в точках кипения более 19°, и здесь довольно ясно заметно, что точки кипения кислот с нечетным числом атомов углерода, а именно CH 2O2 — 101°, C3H6 O — 143° и C 5H10O2 — 185° лежат на одной прямой (разность между 143 — 101 = 185 — 143), а точки кипения кислот с четным числом атомов углерода (C 2H4O2 — 118°, C4H8O2 — 161,5° и C 6H12O2 — 205°), на другой, лежащей несколько ниже (разности между 205° — 161,5° — 118° = 43,5° и несколько выше предыдущих); нормальные кислоты имеют наиболее высокие точки кипения — все их изомеры кипят ниже; начиная с C 9 (кислоты пеларгоновой; см.), П. кислоты не перегоняются без разложения под атмосферным давлением. Удельные веса П. кислот падают по мере увеличения частицы, так как одновременно и процентный состав их приближается к составу углеводородов; удельный вес первых трех кислот выше удельного веса воды, а именно: CH 2O2 = 1,231 (10°), C2H4O2 = 1,052 (16,5°) и C 3H6O2 = 1,013 (0°); удельные веса остальных кислот ниже единицы. Низшие члены ряда растворимы хорошо в воде [Свойство это находится в связи со строением: нормальная масляная кислота смешивается с водой во всех отношениях, а изокислота не обладает этим свойством (см.).]; с увеличением частицы растворимость быстро падает. В спирте и эфире все одноосновные кислоты хорошо растворимы. Кислотные свойства высших членов ничтожны. Число изомеров П. одноосновных кислот равно числу существующих первичных спиртов или альдегидов с данным числом атомов углерода; изомерия всецело обусловлена изомерией углеводородного остатка, соединенного с карбоксилом (см. Строение химическое). Кислоты общей формулы R—CH 2—CO2 H называются первичными, RXCH—CO2H — вторичными и RXYC—CO 2H — третичными (R, X и Y — остатки П. углеводородов). Как кислоты, все они образуют соли (см.), эфиры (см.), ангидриды (см.), галоидангидриды (см. Хлорангидриды), амиды (см.) и нитрилы (см.); при действии галоидов (лучше всего хлора и брома) они дают галоидозамещенные кислоты, от которых нетрудно перейти к окси-, амино- и нитрокислотам и т. д. От П. кислот легко можно перейти к альдегидам (см.) и спиртам первичным (см.), к кетонам (см.), спиртам третичным (см. Триметилкарбинол), к парафинам (см.) и через амиды к аминам. Современные представления о строении П. одноосновных кислот выработаны при изучении уксусной кислоты. В 1839 г. Дюма, действуя на уксусную кислоту хлором на солнечном свету, получил кристаллическую кислоту состава C 8Cl6O6·2HO (С = 6; O = 8); кислоту эту, которая по формуле являлась продуктом замещения в уксусной кислоте C 3H6O6 ·2HO шести атомов водорода хлором, Дюма назвал "хлоруксусной" кислотой. По основности хлоруксусная кислота не отличалась от уксусной (обе одноосновны), и Дюма указал, что в "органической химии имеются (следовательно) известные типы (см.), которые сохраняют свой характер даже и в том случае, когда вместо водорода, заключающегося в них, вводятся в соединение равные объемы хлора, брома или йода" (ср. Замещение). Персоц, а затем Дюма (в 1840 г.) нашли, что "хлоруксусная кислота под влиянием щелочей распадается на хлороформ (см.) и углекислоту: C 8H2Cl6O8 = 2C2O4 + 2C2HCl3, аналогично распадению уксусной кислоты при сплавлении со щелочью на углекислоту и метан (см. Парафины): C 8H2H6O8 = 2C2O4 + 2C2HH3. Наконец, Мельсанс (в 1842 г.) показал, что при действии амальгамы калия "хлоруксусная" кислота замещает хлор водородом, превращаясь обратно в уксусную кислоту. Тождество "типа" уксусной и "хлоруксусной" кислот нельзя было теперь отрицать, и Берцелиус, раньше противившийся признанию такового (см. Электрохимическая теория), должен был его признать, что и сказалось на формулах этих кислот, предложенных им в его учебнике; обе, по его мнению, должны представлять "сочетанные" производные радикала "метила" и щавелевой кислоты, а именно "хлоруксусная" должна быть: C 4Cl6 + C4O6, а уксусная — C 4H6 + C4O6 (C = 6, O = 8). [Под кислотами Берцелиус подразумевал теперешние ангидриды кислот. C 4O6 несуществующий ангидрид щавелевой кислоты. Формулы Берцелиуса несколько отличались от приведенных в тексте, так как Берцелиус употреблял удвоенные, перечеркнутые паи (см. Пай).] Формулы эти противоречили водородной теории кислот Дэви-Либиха, теории, сохранившейся и до настоящего времени (см. Кислоты); кроме того, они шли вразрез с "унитарной" теорией (см.), точно так же признаваемой и ныне, и тем не менее они послужили точкой отправления для работ Кольбе и Франкланда; работы эти, как казалось, их отчасти оправдали. Кольбе понимал под радикалами (см.) группы атомов, существующие в соединениях, как таковые, считал их аналогичными до известной степени с атомами элементарных тел и, убежденный в правильности представлений Берцелиуса, предпринял вместе с Франкландом (в 1848 г.) ряд опытов над разложением уксусной кислоты на ее радикалы. Электролиз уксусной кислоты позволил, как думали авторы, выделить один из них, а именно метил (см. Парафины и Радикалы), что же касается радикала щавелевой кислоты, то неполучение его (по Кольбе) должно было объясняться способностью окисляться под влиянием кислорода разлагающейся одновременно воды (считаемой нами теперь конституционной). В предыдущем (1847) году Дюма получил нагреванием уксусно-аммиачной соли с фосфорным ангидридом цианистый метил, и для дальнейшего доказательства правильности своих взглядов Кольбе и Франкланд превращают теперь (1848) обратно нитрилы [Цианистые эфиры (иначе нитрилы; см.) были раньше синтезированы Пелузом при нагревании солей серно-винных кислот с цианистым калием: C 2H5—O—SO2—OK + KCN = C2H5—CN + KO—SO2—OK (C = 12, O = 16, S = 82, K = 39 и N = 14).] в кислоты. Опыт, таким образом, показал, что допущение предсуществования метила в уксусной кислоте правильно, и позволил Кольбе впоследствии развить свою теорию замещения (ср. соотв. ст.), изложенную им в статье: "Ueber den natürlichen Zusammenhang der organischen mit den unorganischen Verbidungen, die wissenschaftliche Grundlage zu einen naturgemässen Classification der organischen chemischen Kö rper" [Ко времени появления этой статьи подоспел синтез Ванклина пропионовой кислоты (см. выше) из углекислоты и натрий-этила (1857). Статья Кольбе вышла теперь отдельным изданием в Ostwald's "Klassiker der exakten Wissenschaften" (№ 92, 1897).] (подробности см. Строение химическое). Современная формула уксусной кислоты (см.) рассматривает ее почти с той же точки зрения, которая была установлена Кольбе, с той лишь разницей, что формула Кольбе (Берцелиуса) могла бы до известной степени объяснить удвоенный вес частицы уксусной кислоты и ее гомологов, а наши формулы этого сделать не в состоянии. Первая первичная кислота, кислота уксусная, была синтезирована Кольбе; первая вторичная кислота, изомасляная (см. Масляные кислоты) — Марковниковым и первая третичная кислота, триметилуксусная — Бутлеровым. Частные описания П. одноосновных кислот общей формулы C nH2nO2 см. Валериановые кислоты, Жирные кислоты, Масло коровье, Лавровая, Лигноцериновая, Масляные, Мелиссиновая (Воск; см.), Муравьиная, Пальмитиновая, Пропионовая, Стеариновая, Уксусная и Ундециловая кислоты.
П. двухосновные и двухатомные кислоты обладают общей формулой C nH2n(CO—OH)2 = CnH2n-2O4. Общих методов синтеза их не имеется, а потому подробности см. Щавелевая, Малоновая, Янтарная, Глутаровая, Адипиновая, Пимелиновая, Пробковая, Себациновая кислоты и их гомологи. Все это твердые, хорошо кристаллизующиеся вещества, большей частью хорошо растворимые в воде (за исключением высших членов) и нерастворимые в хлороформе; реакция их сильно кислая. Они не летучи с парами воды. Гомологи малоновой кислоты легко при нагревании распадаются с выделением CO 2; гомологи янтарной при нагревании легко теряют H 2 O, превращаясь в ангидриды (об отщеплении ими CO 2 см. выше); кислоты, у которых карбоксильные группы более удалены друг от друга, могут иногда перегоняться без разложения. Строго такое деление, впрочем, провести не удается. Что касается температуры плавления нормальных двухосновных П. кислот, то и для них наблюдается, что кислоты с четным числом атомов углерода плавятся выше кислот с нечетным числом атомов углерода (Байер); разница с одноосновными кислотами проявляется, главным образом, в том, что у первых с увеличением частицы температура плавления падает (см. фиг. 2), а у вторых возрастает, так что между кислотами C 20 и C 30 можно ожидать пересечения кривых, а следовательно, обращения правильности, если только не будет найден такой же минимум, какой наблюдается для кислот одноосновных, содержащих C 4 и C 6 (см. выше).
Фиг. 2.
Относительно П. кислот большой основности см. Три- и Тетракарбоновые кислоты, а также Трикарбаллиловая кислота.
П. оксикислоты одно- и многоосновные — см. Спиртокислоты. Отдельные представители их см. кислоты: Угольная, Гликолевая, Гидракриловая, Глицериновая, Молочная, Оксимасляные, Оксиглутаровые, Винные, Лимонная, Сахарная кислота и ее изомеры и т. д.
Согласно постановлению Женевского конгресса 1892 г. названия одноосновных жирных кислот, во-первых, производятся от названия соответственного углеводорода [Во французской редакции: "Le nom des acides menobasiques... ist tir é de celui de l'hydrocarbone correpondant urvi du suffixe — oï que". В немецкой редакции суффикс выпущен и l'acide éthanoï que переведена как Ethans ä ure. Ф. Ф. Бейльштейн предложил и по-русски называть ее этанкислотой.], многоосновные кислоты получают названия — "ди-, три-, тетракислоты"; и во-вторых, их карбоксил считается нераздельной частью углеродного скелета. Номенклатура удобна, пока мы имеем дело с нормальными кислотами, или когда карбоксил находится в наиболее длинной цепи; так H—CO 2 H есть метанкислота (муравьиная), CH 3—CH2—CO2 H — этанкислота (уксусная), CH 3—CH2—CO2 H — пропанкислота (пропионовая), CH 3—CH2—CH2—CO2 H — бутанкислота (масляная), HO 2C—CH2—CH2—CO2 H — бутандикислота (янтарная) и HO 2C—CH(CH3)—CH(CH3)—CO2 H — диметил-(2,3)-бутандикислота (диметилянтарная симметричная). Когда карбоксил помещается в боковой цепи, то уже появляются затруднения; Комб предлагает называть кислоту этилизопропилуксусную: CH 3—CH(CH3)—CH(CO2H)—CH2—CH3, — метил-2-пентан-метил-3-кислота, [Acide m éthyl-2-pentane-méthyloï que 3.], а кислоту ацетилентетракарбоновую: HO 2C—CH(CO2H)—CH(CO2H)—CO2 H — диметил-2,3-кислота-бутандикислота, [Acide dim éthyloïque 2,3-butane-dioï que, y Ф. Ф. Бейльштейна — Butandis äure-2,3-Dimethylsä ure.], но пока общепринятой номенклатуры (особенно русской) нет. 3) В одноосновных кислотах с нормальной или симметричной углеродной цепью углерод карбоксила считается первым, во всех других случаях сохраняется нумерация углеводородов (см. Парафины):
(1)CH3—(2)CH2—(3)CHBr—(4)CO2H — α-монобромомасляная есть, следовательно, бромо-2-бутанкислота, а
(1)CH3—(2)CH(CH3)—(3)CH2—(4)CO2 H — изовалериановая кислота есть метил-2-бутанкислота-4 (подроб. см. Химическая номенклатура).
А. И. Горбов. Δ .
| "БРОКГАУЗ И ЕФРОН" >> "П" >> "ПР" >> "ПРЕ" >> "ПРЕД" |
Статья про "Предельные органические кислоты" в словаре Брокгауза и Ефрона была прочитана 2738 раз
| Пицца в сковороде |
| Крабы в кокосовом молоке |
TOP 15
- Волос
- Проно
- Степные животные
- Гимнастика
- Индийский океан
- Архитектура
- Сравнение, в литературе
- Манда
- Клитры
- Колесование
- Испарение
- Травоядные животные
- Оплодотворение у pacтений
- Вредные насекомые
- Электризация тел