


БНБ
"БРОКГАУЗ И ЕФРОН" (121188)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Правило фаз
Определение "Правило фаз" в словаре Брокгауза и Ефрона
Правило фаз
Правило фаз*
(хим.) — неоднородность любой химической системы, находящейся в равновесии, может обуславливаться только одновременным присутствием в ней различных однородных тел, взаимно соприкасающихся; таков, напр., случай твердой соли и находящегося над ней насыщенного раствора и т. д. Отдельные, однородные тела, из которых сложена система, могут быть в газообразном, жидком или твердом состояниях; число твердых тел и число взаимно не растворяющихся жидкостей, которые принимают участие в равновесии, не подлежит какому-либо ограничению; что касается паро- или газообразных тел, то благодаря способности их смешиваться во всех отношениях, паро- или газообразный комплекс, входящий в систему, должен быть всегда в единственном числе. Гиббс предложил называть фазами те физически и химически одпородные массы (иначе, массы однородной концентрации), из которых сложена данная неоднородная равновесная система. Фазами могут быть потому и физич. смеси, и химически однородные тела; число их, следовательно, не всегда совпадает с числом химических тел, которые могут быть выделены из данной системы; так, всякий раствор, будет ли он твердый (см. Растворы), жидкий или газообразный, представляет собой отдельную фазу, за химические же тела (простые или сложные), ее образующие, мы должны принимать исключительно те, концентрация которых может быть произвольно изменена. Напр., при рассмотрении равновесия между углекальциевой солью, окисью кальция и углекислым газом, за тела, слагающие данную систему мы должны принять СО 2 и СаО, потому что их концентрация может быть произвольно изменяема и их двух вполне достаточно для образования всех тут возможных равновесных систем (ср., что сказано ниже при двух реагирующих телах); нельзя принять за слагающие сами элементы кальций, кислород и углерод, так как они не представляют независимых переменных и, что не менее важно — не находятся в равновесии с данной системой [Paзличиe числа не зависимых друг от друга тел, образующих данную равновесную систему, от числа химических индивидуумов, в ней могущих содержаться, еще яснее выступает на следующем примере. Положим, что в воде растворены одновременно хлористый калий и бромистый натрий, в силу двойного разложения они дадут некоторые количества бромистого калия и хлористого натрия. Нетрудно убедиться, что несмотря на присутствие четырех солей, мы имеем дело всего с тремя независимыми переменными (предполагая концентрацию первоначально взятых солей определенной). Действительно, представим себе, что количества КСl, КВr и NaCl нами установлены, количество неизмененного NaBr, очевидно, будет тем самым косвенно определено; оно не является, следовательно, независимым. К тому же заключению приводит и то соображение, что достаточно в данном случае трех аналитических данных (напр., определений количеств K, Cl, Br), чтобы иметь возможность вычислить четвертое неизвестное (содержание Na, Мейергоффер). Аналогичные соображения позволяют обходиться, не прибегая к теории электролитической диссоциации, при изложении с точки зрения П. фаз случаев равновесия водных растворов солей (Банкрофт).]. Гиббсу (Gibbs) принадлежит положение, что в системах, находящихся под равномерным влиянием тяготения, электрического, капиллярного или какого-либо иного натяжения, — состояние фаз определяется: давлением и температурой системы и химическими потенциалами тел, из которых она (система) сложена. При равновесии — потенциал данного тела, находящегося в различных фазах, обладает определенной постоянной величиной, и потому: 1) для любой фазы мы можем составить уравнение, которое будет связывать эти величины между собой, и 2) для каждой другой фазы, находящейся в равновесии с первой, будем иметь такого же вида уравнение, содержащее те же переменные. Несмотря на то, что неизвестны ни эти отдельные уравнения, ни химические потенциалы участвующих в данной системе тел, все же эти соображения позволили Гиббсу вывести вполне определенные заключения о характере и числе возможных случаев равновесия при неизвестном числе тел, участвующих в образовании системы. Действйтельно, число независимых переменных для n тел, по определению равно "n + 2" (n химических потенциалов + температура + давление), а следовательно, число теоретических уравнений равно числу переменных только при наличности "n + 2" фаз; это число фаз является, кроме того, максимальным для n не зависимых друг от друга химических тел. Только в этом случае все переменные имеют вполне определенное численное значение, иначе говоря, сосуществование "n + 2" фаз влечет за собой определенное соотношение между температурой и давлением; такие системы, не обладающие степенью свободы (Рике), Тревор называет безвариантными (nonvariant system). Если условиться откладывать температуры по оси абсцисс прамоугольных координат, а по оси ординат — давления, то в плоскости координат всегда можно найти такую точку, которая будет изображать состояние системы, сложенной из n тел и имеющей "n + 2" фаз; эту точку принято называть "инверсионной", или "точкой обращения" (Фан'т-Гофф). Когда при n реагирующих телах имеется налицо только "n + 1" фаз, то число неизвестных превышает на единицу число уравнений, которые можно для нее построить, и система оказывается обладающей одной степенью свободы, моновариантной (по Тревору — monovariant system); для такой системы величина одной из переменных, или температуры, или давления, может быть произвольно выбрана; ряду данных температур будут в ней отвечать вполне определенные давления, и наоборот, определенные давления возможны будут только при определенных температурах; в диаграмме температур и давлений такой системе будет отвечать уже не точка, а кривая линия. Если представить себе, что из сосуществующих при инверсионной точке "n + 2" фаз по очереди будет исчезать какая-нибудь из них, то, очевидно, мы получим в координатной плоскости "n + 2" кривых, которые все будут пересекаться при "точке обращения". Система из n тел, образованная n фазами, называется дивариантной (divariant system); две переменные могут быть в ней заранее выбраны, и в диаграмме температур и давлений такой системе отвечает определенная площадь, границы которой определяются кривыми моновариантных систем. В дивариантной системе при данной температуре можно иметь (при соответственных изменениях концентраций) целый ряд давлений; при данном давлении температура может меняться в зависимости от концентрации, или наоборот, концентрация может меняться с изменением температуры и т. д. Наконец, системы из n слагаемых (реагирующих тел), состоящия из n — 1, n — 2 и т. д. фаз называются три-, тетравариантными и т. д. (trivariant, tetravariant system); число степеней свободы, очевидно, возрастает по мере увеличения числа реагирующих тел, сравнительно с числом фаз; на практике иcследование три- и т. д. вариантных систем не представляет интереса благодаря их малой определенности и слишком большому числу возможных комбинаций. Системы, обнимаемые П. фаз, подчинены, как равновесные, общему закону Ле-Шателье, по которому, "всякие изменения внешних факторов равновесия влекут за собой обратные изменения внутри системы" (см. Обратимость химических реакций), а именно: 1) нарастание температуры вызывает в системе превращение, стремящееся понизить температуру, поглощающее, следовательно, тепло, и обратно, и 2) всякое увеличение внешнего давления вызывает такое перемещение равновесия, которое влечет за собой понижение давления, состоящее, следовательно, в уменьшении объема системы, и обратно. Следующие частные случаи наглядно поясняют вышеизложенное.
I. Одно реагирующее тело (вода, бензол, сера, фосфор). При одном реагирующем теле (т. е. при n = 1) максимальное число для сосуществующих фаз равно 1 + 2 = 3; это число, отвечающее безвариантной системе, возможно только при температуре и давлении, отвечающих инверсионной точке; при всяких же других величинах температуры и давления могут сосуществовать уже maximum n + 1, т. е. 2 фазы. В диаграмме температур и давлений инверсионная точка должна представлять точку пересечения трех пограничных кривых для трех возможных моновариантных систем. Фиг. 1, схематически изображающая равновесие для воды в ее различных физических видоизменениях, все это ясно показывает.
Фиг. 1.
А есть инверсионная точка, в которой может одновременно существовать вода в трех видах (фазах): вода газообразная (вернее, парообразная), вода жидкая и твердая (лед). Температура, отвечающая ей = + 0,0075°С, а давление = 4,57 мм (см. Вода и Лед). Стоит хотя бы незначительно изменить или температуру, или давление, чтобы тотчас вызвать вполне определенное превращение в системе, состоящее в исчезновении одной из фаз. Так, если мы будем уменьшать температуру системы, то исчезнет жидкая вода и останется система из льда и пара; давление испаряющегося льда будет меняться — падать с падением температуры, но так как лед может существовать (ниже точки А) при различных температурах и давлениях, то, очевидно, равновесие между ним и паром должно выражаться кривой АО (фиг. 1); экспериментально она прослежена для очень малого участка температур, теоретические же соображения заставляют предполагать, что эта кривая должна кончаться в нулевой точке координат, т. е. при абсолютном нуле температуры (при — 273°С, Нернст); это обозначено пунктиром. Кривая ОА есть вместе с тем кривая возгонки льда (ср. Пар) или максимального его давления. Диаграмма ясно показывает, что если при постоянной температуре над системой из льда и пара уменьшать давление, то этого нельзя сделать, пока еще остается хоть небольшое количество льда, и только после полного испарения его давление может быть понижено; и наоборот, повышение давления невозможно, пока еще над льдом данной температуры имеется пространство, наполненное паром. Если повышать температуру системы (выше инверсионной точки А), то должна исчезнуть фаза льда, и рассуждениями, вполне подобными только что изложенным, нетрудно прийти к выводу, что кривая АС есть кривая максимальной упругости паров воды в присутствии жидкой воды, т. е. так называемых насыщенных паров (см. Вода). Ниже нее лежиг область пара ненасыщенного или перегретого (см. Вода), непосредственно выше — область жидкой воды. Относительно пограничных точек кривой АС надо заметить следующее. Как показано пунктиром, она может быть экспериментально прослежена на некотором расстоянии ниже точки А, где кривая DA отвечает упругости переохлажденной воды (ср. Лед и Пар), но современные сведения не позволяют решить, отвечает ли ее конец какому-нибудь определенаому физическому изменению воды, или же кривая точно так же должна окончиться в нулевой точке координат (Нернст), т. е. не должна ли диаграмма иметь вид, представленный на фиг. 2. Справа кривая АС имеет, напротив, вполне твердо установленное окончание, и именно абсцисса точки С представляет так называемую критическую температуру воды, а ее ордината давление при критической температуре, т. е. 365° и 200 атм. (Кальете и Колардо). При температурах выше критической жидкая вода нсчезает, превращаясь нацело в газообразную; моновариантная система (вода — насыщенный пар) сменяется, следовательно, дивариантной (критическая точка та, при которой две фазы становятся тождественными; Оствальд), для которой могут быть по произволу выбраны величины давления и температуры, что и показано расходящимися из точки С пунктирными прямыми (фиг. 1), которые изображают наблюденные Кальете и Колардо давления газообразной воды в зависимости от количества ее, подвергавшегося нагреванию; прямой ход их показывает, что и при этих высоких температурах и давлениях газообразная вода еще довольно близко следует закону Гей-Люссака для расширения газов. Может ли быть газ переохлажден ниже критической температуры и будет ли он тогда обладать каким-нибудь оиределенным давлением, — до сих пор не решенный вопрос; согласно П. фаз величины температуры и давления в однородных, дивариантных системах могут быть выбраны по произволу, а ход кривой при данной массе вещества находится в зависимости от его концентрации, т. е. от объема, занятого им [В этом отношении диаграмма, приведенная Банкрофтом в его сочинении "The Phase Rate", является, несомненно, ошибочной.]. С кривыми ОА и AC в точке А пересекается еще третья кривая АВ; она отвечает равновесию между льдом и водой при отсутствии газообразной фазы, следоватольно, под давлением. Как видно по нанесенной пунктиром вертикальной линии NN1N2, кривая AB отклоняется влево, что происходит потому, что лед обладает меньшим уд. весом, чем вода, и с увеличением давления температура плавления льда понижается (кривая, благодаря уменьшению абсциссы, должна приближаться к оси y -ов). Пунктирные прямые ММ 1 М 2 и NN1N2, из которых первая параллельна оси х-ов, а вторая оси у-ов, легко позволяют ориентироваться в тех изменениях, которым должна подвергаться исследуемая система в одном случае при изменении только температуры (след., при постоянном давлении), а в другом при изменении давления (при постоянной температуре); ясно, что если при постоянном давлении понижать температуру газообразной (парообразной) воды, то, пока температура не понизится до М 1, будут иметься налицо условия моновариантной системы; в точке M2 она превратится в безвариантную (жидкость + определенное давление + насыщенный пар), затем снова в моновариантную (отрезок М 1 М 2 отвечает жидкой воде + определенному давлению), которая в M2 становится безвариантной (жидкая вода + лед + определенное давление) и т. д. В точках М 1 и М 2 как нетрудно видеть, должны происходить остановки в ходе температуры до полного исчезновения в M1 газообразной фазы, а в M2 — жидкой. Одинаково понятно, что на прямой NN1N2 должно встретиться две особых точки в N1 и N2, в которых давление не может возрастать, пока не исчезнет в N1 — газо-(паро)-образная фаза, а в N2 — твердая (лед). В большинстве случаев соответственные диаграммы для других тел, способных существовать в различных физических состояниях, отличаются от диаграммы фиг. 1 в том отношении, что благодаря большему (сравнительно с жидкостью) уд. весу твердых тел при точке плавления, кривая моновариантной системы (твердое тело + жидкое) отклоняется вправо от оси у-ов, а не влево.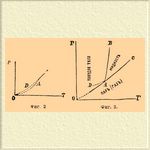
Фиг. 2. Фиг.3.
Фиг. 3 отвечает этому случаю; так, например, для бензола точка D лежнт при 5,58° (Ферхе) при давлении его пара в 36,06 мм ртутного столба, точка С при 288,5°С и давлении в 47,5 атмосфер (Юнг, Рамзей), а кривая AB отклоняется вправо и приблизительно на 0,03° при увеличении давления на одну атмосферу (при 4,92 атм. точка плавления бензола повысилась на 0,143°; Ферхе). Явление усложняется при возможности аллотропических (см. Изомерия) форм. Пока неизвестны тела, для которых существовали бы две жидких фазы, но для порядочного числа тел найдены два и более твердых видоизменения. Это влечет за собой возможность существования, кроме точки плавления, еше других инверсионных точек.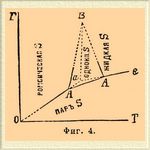
Фиг. 4.
Такова, напр., сера. Для нее с несомненностью (Митчерлих) установлены два аллотропических видоизменения: сера, так называемая октаэдрическая, кристаллизующаяся октаэдрами ромбической системы, и сера призматическая, являющаяся в виде вытянутых призм одноклиномерной системы. Фиг. 4 представляет схематически наблюдаемые тут равновесные системы. При обыкновенной температуре, ромбическая сера является более устойчивым видоизменением и кривая аО представляет собой кривую ее возгонки, аС есть кривая упругости насыщенного пара жидкой серы и, наконец, аВ — кривая, отвечающая моновариантной системе: ромбическая сера + жидкая. Инверсионная точка a (точка плавления ромбической серы) лежит при 114,5° (Броди). При 120° лежит другая инверсионная точка А 1, отвечающая плавлению одноклиномерной серы; в ней сосуществуют: сера одноклиномерная (площадь АА 1 В), сера жидкая (площадь BA1C) и пар серы; кривая АА 1 представляет, следовательно, кривую возгонки одноклиномерной серы, а А 1 В — кривую равновесия одновариантной системы: сера одноклиномерная + жидкая. Третья инверионная точка А обусловливается сосуществованием фаз: сера ромбическая + сера одноклиномерная + пар; она лежит при 95,55° (Рейхер, Фан'т-Гофф), и наконец, четвертая, пока не наблюдавшаяся экспериментально инверсионная точка В может лежать по приблизительному расчету Б. Роозебоома около 131°С при 400 атмосферах давления. Что касается кривых, отвечающих моновариантным системам, то они до сих пор очень мало изучены. Ниже точки А давление паров серы слишком незначительно, чтобы его было удобно наблюдать. Кривая АА 1 не наблюдалась непосредственно. Необходимость отклонения кривой АВ вправо следует с несомненностью из того, что уд. вес ромбической серы = 2,07 (Маршаль и Шефер) выше уд. веса одноклиномерной = 1,958 (С. К. Девилль) и что превращение одноклиномерной серы в ромбическую сопровождается выделением тепла (Митчерлих); кроме того, Рейхер прямым опытом установил, что с повышением давления температура равновесия между ромбической и одноклиномерной серой повышается около 0,049°С на каждую атмосферу давления, так как при 60 атм. точка равновесия находится при 96,2°; выше этой температуры и этого давления кривая не прослежена. Что касается кривой А 1 В, то ее направление нанесено гадательно на основании некоторых данных, по которым уд. вес жидкой серы меньше уд. веса одноклиномерной. Положение точки B, очевидно, тоже в высшей степени гадательно [В тексте дана диаграмма фан'т-Гоффа. На диаграммах у Мейергоффера и Банкрофта (см. в конце литературу) кривая А 1B тоже отклоняется вправо.]. Выше нее не может существовать одноклиномерная сера (заиимающая сравнительно ограниченную площадь АВА 1; разность между абсциссами точек А и A1 = 24,45°С, разность ординат точек А и В около 400 атм.), а двухфазная система (сера твердая + жидкая) должна быть образована серой ромбической + жидкой серой. В минералогическом отношении это важно потому, что объясняет ход образования кристаллов самородной серы; при обыкновенном давлении из расплавленной серы получается одноклиномерная сера, а при давлениях выше 400 атм. даже и без переохлаждения могла бы получаться ромбическая (Фан'т-Гофф). Наблюдаемые на опыте явления не совсем так просты, как они только что изложены, и усложнение обуславливается главным образом тем, что превращения ромбической серы в одноклиномерную и обратно происходят не мгновенно, а требуют, напротив, довольно значительного промежутка времени, благодаря чему можно наблюдать, напр., точку плавления октаэдрической серы, лежащую в области одноклиномерной серы (см. фиг. 4), а во-вторых, можно иметь и одноклиномерную серу при температурах, лежащих ниже точки А в переохлажденном состоянии; прибавка кристаллика октаэдрической серы (Жернез) или даже незначительного количества какого-нибудь растворителя серы (Митчерлих) очень способствует устранению явлений переохлаждения. Кроме нанесенных на диаграмме 4 кривых, отвечающих более твердо установленным аллотропическим видоизменениям серы, на ней должна бы еще быть нанесена кривая, изображающая упругость пара твердой серы, не растворимой в сероуглероде. Ход этой кривой до сих пор не установлен экспериментально; насколько можно думать, по имеющимся до сих пор наблюдениям (Бертело, Девиль, Жернез), кривая эта должна пересекать кривую ОА где-то около точки А (может быть выше нее) и затем при температурах около 250° пересекать линию А 1 С; в точках пересчения будут, очевидно, иметься условия для безвариантных систем. Яснее эти отношения установлены для фосфора, относительно которого мы ограничиваемся только схематической диаграммой, данной Банкрофтом (фиг. 5).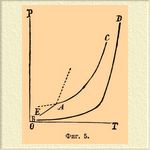
Фиг. 5.
ЕА — кривая возгонки твердого белого фосфора, AC — кривая упругости насыщенного пара жидкого фосфора; пунктирное продолжение AC — упругость паров переохлажденного жидкого фосфора; другая пунктирная линия из А отвечает моновариантной системе: фосфор твердый + фосфор жидкий; кривая BD — кривая давления паров красного фосфора. Несмотря на неустойчивое равновесие, белый фосфор не переходит сам собой в красный. Как видно, во всех случаях, согласно требованию теории, во всех инверсионных точках имеются по три фазы. И наоборот, определение числа сосуществующих фаз позволяет решить, сколько независимых переменных принимают участие в равновесии; необходимо только, чтобы на системе не сказывалось влияние тяготения, капиллярных сил и т. д. (см. выше), а чтобы изучение ее велось при давлениях и температурах, свойственных самой системе, потому что наличность какого-нибудь определенного давления или определенной температуры, как было указано при обсуждении диаграммы для воды, понижает степень свободы системы, превращая дивариантную в моновариантную, а моновариантную в безвариантную, что влечет за собой нахождение ложных инверсионных точек.
II. Два реагирующих тела. При двух реагирующих телах максимальное число фаз равно 4-м; три фазы образуют моновариантную систему и т. д. Можно различить, по-видимому, два типа, смотря по тому, отсутствует между фазами жидкая фаза или же она имеется налицо. Первый случай (отсутствие жидкой фазы) тесно примыкает к только что разобранным явлениям перемены однородными телами физического состояния. Если пар (или газ), выделяемый данной твердой однородной системой, отличается от нее по химическому составу, то, очевидно, что часть ее претерпевает химическое разложение, продуктами которого являются выделяемый газ и некоторый остаток; газ и остаток являются, таким образом, теми телами, теми независимыми переменными (см. что сказано выше о разложения СаСО 3), из которых может быть построена исходная система. Пока она не вся распалась, мы имеем дело с тремя фазами: исходная система + газ + остаток, иначе говоря — с моновариантной системой, и в ней определенной температуре должно отвечать определенное давление и наоборот, как, напр., при испарении жидкостей. Аналогия идет дальше и в том, что величина давления (при данной температуре) не зависит от отношения между массами исходной системы и твердого продукта распада ее. Сюда могут быть отнесены: диссоциация исландского шпата на окись кальция и углекислоту (Дебрэ, Ле-Шателье; см. Диссоциация), диссоциация солей, с кристаллизационной водой (Дебрэ, Видеман, Лекёр и др.) или кристаллизационным аммиаком (Изамбер) и т. д. (см. соотв. ст.). Во втором случае, когда присутствует жидкая фаза, изменение давления (при постоянной температуре) влечет за собой изменение равновесия, а вместе с тем изменение относительного состава одной (или нескольких) фаз. Представим себе воду при постоянной темп.; достаточно незначительно уменьшить давление, чтобы заставить ее до конца испариться; явление резко меняется, когда в ней растворена какая-нибудь соль, что, как известно, влечет за собой понижение давления пара в зависимости от концентрации соли; если над таким раствором уменьшить на какую-нибудь небольшую, но определенную величину давление, то испарится (при постоянной температуре) уже не вся вода, а только часть ее, и это потому, что по мере испарения воды возрастает концентрация соля и соответственно падает упругость пара раствора; испарение, очевидно, прекратится, когда она (упругость) сравняется с данным давлением. Таким образом состояние равновесия систем, заключающих фазы переменного состава (растворы), находится в зависимости от относительных количеств реагирующих тел в этих фазах, или, иначе, от их концентраций. Эти последние измеряются гораздо легче давлений пара растворов, и потому мы будем пользоваться тут и диаграммами, в которых ординатами будут не давления, а концентрации. Следующие примеры поясняют сказанное. Пусть дан раствор азотнокислого серебра в воде. Четыре фазы в этом случае: твердое AgNO 3, лед, раствор и парообразная Н 2 О [Теоретически можно ожидать, что с паром воды будет и парообразное AgNO 3, но на практике мы можем его считать в данных пределах температуры совершенно не летучим.]; сосуществование их обуславливает безвариантность системы, которой на диаграмме температур и давлений (фиг. 6) отвечает точка А; в ней, как видно, пересекаются четыре кривых, отвечающих четырем возможным моновариантным системам. Кривая ОА 1 отвечает одновременному присутствию: твердой соли, льда и пара Н 2 О; согласно опытам Реньо, который нашел, что присутствие твердой соли не влияет заметным образом на упругость пара льда, мы должны считать эту кривую тождественной с кривой ОА фиг. 1. Кривая A1MF отвечает одновременнному присутствию твердой соли, раствора и пара воды, т. е. отвечает упругости пара, так называемых, насыщенных растворов AgNO 3 в воде; с возвышением температуры, как видно, кривая быстро поднимается кверху, переходит через максимум (М), после которого наступает быстрое падение ее; под конец она падает вертикально (Б. Роозебоом), пересекая ось х-ов при температуре плавления безводной AgNO 3 (+ 198°С), при каковой температуре AgNO 3 смешивается во всех отношениях с водой (растворимость AgNO 3 в воде при этой температуре безгранично велика). Кривая А 1 В 1 отвечает одновременному присутствию льда, AgNO 3 и раствора; экспериментально она не изучена; можно только сказать, что она должна отклоняться влево, потому что система из льда и твердой соли удельно легче жидкой системы того же состава. Каждая из площадей чертежа имеет вполне определенное значение; площадь ОА 1MF дает условия сосуществования AgNO 3 и пара Н 2 О, площадь ОА 1B1 — AgNO3 и льда; В 1 А 1 М — для AgNO 3 и раствора. Точка А есть криогидратная точка, т. е. такая, при которой раствор нацело застывает, распадаясь на AgNO 3 и лед, но только криогидратная точка не под атмосферным давлением, а под максимальным давлением упругости насыщенного при этой температуре раствора AgNO 3. Пока мы имели дело только с насыщенными растворами при разных температурах и разных давлениях. Для того, чтобы диаграмма обнимала собой растворы любой концентрации (до чистой воды, как предела уменьшения концентрации), необходимо соединить фиг. 6 с фиг. 1-й. Благодаря неизменяемости упругости пара льда от присутствия соли — при наложении этих чертежей друг на друга кривые ОА 1 (фиг. 6) и ОА (фиг. 1) должны до температуры, отвечающей точке А 1 (фиг. 6), совпасть между собой; в силу того же самого кривая А 1 А (фиг. 6), отвечающая сосуществованию льда, раствора и пара воды должна тоже совпасть с линией ОА (фиг. 1). Точки А, В и С (фиг. 6) представляют собой соответственные точки фиг. 1, и следовательно, площадь ВАС по-прежнему отвечает чистой жидкой воде, а пограничные кривые AB и АС показывают условия превращения воды в твердое (лед) и паро-(газо)-образное состояние.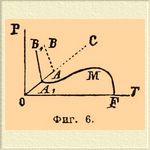
Фиг. 6.
Плошадь CAA1MF обнимает собой область ненасыщенных растворов и пара; она ограничена кривыми: A1MF насыщенных растворов, АС — воды и А 1 А кривой точек плавления льда (выделяемого растворами). Площадь BAA1B1 отвечает области сосуществования ненасыщенных растворов и льда; границами ее являются А 1 В 1 — кривая криогидратных точек (при давлениях больших, чем давление пара криогидратного раствора в точке А 1), AB — кривая понижающихся точек плавления льда с возрастанием давления и кривая А 1 А. Диаграмма ясно показывает: 1) что наименьшей упругостью пара обладают (при любой температуре) насыщенные растворы (см. Растворы); 2) что по мере разжижения их водой (уменьшения концентрации растворенного, нелетучего вешества) упругость их возрастает, приближаясь к упругости пара чистой воды, взятой при той же температуре; 3) что температура выделения из раствора льда (кривая А 1 А) понижается с увеличением концентрации растворенного тела и 4) температура кипения (образования пара определенного давления, равного внешнему давлению, под которым находится система) одновременно возрастает [О законах, которым подчинены депрессии упругостей паров растворов, точек замерения их и т. д. — см. Растворы.]; — но она не дает представления о том, как меняется концентрация насыщенных растворов, а потому естественным дополнением ее служит концентрационно [Под концентрацией соли в данном растворе, согласно Этару, будет подразумеваться количество (весовое) соли в 100 вес. частях раствора (см. Растворы).] температурная диаграмма. Этар нашел, что с повышением температуры азотнокислое серебро растворяется все в меньшем количестве воды и при 198°С (точка плавления AgNOg) становится способным смешиваться с водой во всех отношениях. Если по оси у-ов прямоугольных коорданат откладывать величины концентрации растворов AgNO 3, a по оси х-ов температуры, то, очевидно, кривая [На самом деле он состоит из двух пересекающихся почти прямых линий. Точка пересечения, лежащая при 55°С, отвечает температуре аллотропического изменения AgNO 3. На фиг. 7 для простоты нанесена одна прямая A1F. ] растворимости AgNO 3 должна с повышением температуры, идя слева направо, подниматься и максимальной темп. (абсциссе) 198°С. должна отвечать ордината F (фиг. 7), равная, по условию, 100 (см. примечание).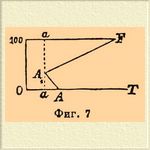
Фиг. 7.
С понижением температуры концентрация раствора падает; следовательно, из него должна выделяться растворенная соль; процесс выпадения AgNO 3 продолжается до тех пор, пока одновременно с солью не начинает выпадать и лед, т. е., пока температура насыщенного раствора не достигнет криогидратной (A1), или в данном случае — 6,5°С. Если пробовать уменьшать еще концентрацию соли, то за криогидратной точкой при охлаждении раствора первым будет выпадать в твердом виде лед (раствор будет не насыщен по отношению к AgNO 3), и кроме того по мере уменьшения концентрации раствора температура образования в нем льда (температура замерзания его должна приближаться к + 0,0075°С (см. выше), а следовательно, кривая от точки A1 должна, падая, идти слева направо и пересекать ось х-ов (при значении ординаты = 0) в + 0,0075°С. Очевидно, кривые AA1 и FA1 являются не только кривыми растворимости, но в то же время они дают и точки плавления: АА 1 льда при возрастающей концентрации AgNO 3, a FA1 — азотнокислой соли в присутствии увеличивающегося количества воды; точка пересечения А 1 представляет наинизшую температуру, которой можно достигнуть смешением AgNO 3 со льдом. Площадь FA1A обнимает собой все ненасыщенные растворы и отвечает площади FMA1AC фиг. 6; площадь ОаА 1 а 100 отвечает площади ОА 1 В 1 фиг. 6, линия A1F изображает состав насыщенных растворов в присутствии пара воды, которым в фиг. 6 отвечала кривая A1MF; точка А 1 — четвертая точка безвариантной системы, линия А 1 А представляет состав растворов при одновременном присутствии льда и пара и, след., отвечает моновариантной системе АА 1 фиг. 6. Таким образом, очевидно, что обе фиг. могут быть представлены, как проекция одна другой
Фиг. 8. Фиг. 9.
Это и сделано на фиг. 8 [Прием введен в употребление Фан'т-Гоффом (см. в конце статьи литературу вопроса).]. Как и все предыдущие, она тоже является схематической. Явления несколько усложняются, когда растворенная в воде соль способна образовать с ней химически определенные гидраты. Фиг. 9 представляет схематический чертеж зависимости между температурой, давлением и концентрациями для водных растворов сернонатриевой соли, которая, смотря по условиям опыта, может выпадать из раствора или в виде Nа 2SO4, или Na 2SO4.10H2 O, или же Na 2SO4.7H2 O. Значение кривых ОА 1A, A1B1, A1C1 то же самое, что в фиг. 6 (вместо А 1 С 1 там A1M), с той разницей, что растворенным телом является в данном случае не AgNO 3, a Na2SO4.10H2 O. Если моновариантную систему из Na 2SO4.10H2 O, насыщенного раствора и пара нагревать, то в точке С 1 наблюдается образование новой фазы, так как из раствора при температуре, отвечающей C1, начинает выпадать безводная соль. Образуется, след., новая безвариантная система, состоящая из Na 2SO4, Na2SO4.10H2 O, раствора и пара и способная существовать, пока не исчезнет вся десятиводная соль, после чего остается новая моновариантная система: Na 2SO4, раствор и пар, которой и отвечает кривая С 1 С 2. В точке C1 таким образом пересекаются две кривых А 1 С 1 и C1C2; последняя поднимается круче первой потому, что выше точки С 1 падает концентрация раствора, благодаря уменьшению растворимости Na 2SO4 с повышением температуры. Вообще, всякий раз, когда при данной температуре растворенная соль претерпевает какое-нибудь изменение, — растворимость продукта изменения выше этой температуры должна быть меньше растворимости неизмененной соли (Ле Шателье, Фан'т-Гофф) [Курнаковым указано, как на исключение, что розео-пентамивовые соли — MX 3.5NH3.H2 O (где М = Со, Cr, Ir, Ro) более растворимы, чем пурпурео-соли — МХ 3.5NН 3, но так как активность группы Х в первых солях иная и, кроме того, розео-соли не образуют с пурпурео-солями в растворе равновесных систем, то едва ли можно считать это действительным исключением.], что связано с поглощением тепла при всяких процессах, обусловленных повышением темп. (закон Ле-Шателье). Линия ОС 3 С 1 есть продолжение С 1 С 2 Температурно-концентрационная диаграмма (схематическая) на той же фиг. 9 показывает, что обеим безвариантным системам отвечают изменения в направлении кривых концентрации. Что касается кривой А 2 С 3 отвечает семиводному гидрату; на верхней половине диаграммы она нанесена пунктиром потому, что упругость пара насыщенных растворов этой соли не изучена; судя по тому, что Na 2SO4.7H2 O образуется при температуре ок. 26°С (Левель), лежащей ниже температуры точки C1 (32,6°; Фан'т-Гофф) и при безвариантной точке С 3 существуют одновременно: Na 2SO4 , Na2SO4.7H2 O-раствор и пар, то надо думать, что упругость пара насыщенных растворов Na 2SO4.7Н 2 О меньше упругости пара насыщенных (при тех же температурах) растворов Na 2SO4.10H2 O. Могут ли обе соли быть в равновесии друг с другом, неизвестно и пока мало вероятно. Судя по диаграмме, это если возможно, то только вблизи криогидратной точки. Некоторые соли (CaCl 2, Fe2Cl4) образуют соединения с кристаллизационной водой, плавящиеся без разложения (Б. Роозебоом); для выяснения наблюдаемых явлений достаточно остановиться на растворах CaCl 2.6H2 O. Если, начиная с криогидр
| "БРОКГАУЗ И ЕФРОН" >> "П" >> "ПР" >> "ПРА" >> "ПРАВ" |
Статья про "Правило фаз" в словаре Брокгауза и Ефрона была прочитана 2188 раз
| Бургер двойного помола |
| Ананасы на гриле |
TOP 15
- Волос
- Проно
- Степные животные
- Гимнастика
- Индийский океан
- Архитектура
- Сравнение, в литературе
- Манда
- Клитры
- Колесование
- Испарение
- Травоядные животные
- Оплодотворение у pacтений
- Вредные насекомые
- Электризация тел