


БНБ
"БРОКГАУЗ И ЕФРОН" (121188)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Поляризация электрическая, или гальваническая
Определение "Поляризация электрическая, или гальваническая" в словаре Брокгауза и Ефрона
Поляризация электрическая, или гальваническая — Электрическою, или гальваническою П., иначе — П. электродов, называется то особое противодействие, какое, кроме сопротивления, претерпевает электрический ток при своем прохождении через находящийся в цепи этого тока электролит, т. е. химически сложное тело, распадающееся от действия тока на две составные части. При нахождении в цепи тока такого тела — электролита — получается на двух, даже вполне однородных, электродах А и В, т. е. проводниках, через которые ток входит в электролит (анод) и выходит из него (катод), разность потенциалов VA—VB, не равная произведению силы тока i на сопротивление электролита r, как это наблюдается в цепи повсюду, где между двумя однородными проводниками, имеющими к тому же одинаковую температуру, заключается какой-либо проводник первого класса (проводник, состоящий из вещества, не разлагающегося действием тока), но выражающаяся через
VA — VB = ir + e...(1)
причем входящая в эту формулу величина е зависит от вещества электролита, вещества электродов, размеров этих электродов, характера поверхности их, силы тока i, температуры электролита и давления, испытываемого последним. Из формулы (1) получается
i = (VA — VB — e)/r ...(2).
Отсюда видно, что при данной разности потенциалов VA — VB на электродах, находящихся в соприкосновении с каким-нибудь электролитом, сила тока, который проходит через этот электролит, получается меньше, чем это будет в том случае, когда та же разность потенциалов поддерживается на двух концах проводника первого класса и этот проводник имеет сопротивление, равное сопротивлению взятого электролита. Из формулы (2) можно заключить, что прохождение тока через электролит сопровождается возникновением особой электродвижущей силы е, стремящейся дать образование току по направлению, обратному тому, который существует в цепи. Такой ток и получается в действительности, когда электролит вместе с его электродами будет отделен от источника тока и электроды будут соединены друг с другом при помощи какого-нибудь проводника. Если промежуток времени от момента отделения электродов электролита от источника тока до момента соединения их каким-либо проводником очень мал, то сила тока, являющегося в первый момент в новой цепи, выражается через
ip = e/(r + R) ...(3)
причем е по величине та же, что и в формуле (1), а R обозначает сопротивление проводника, помощью которого соединяются друг с другом электроды электролита. Этот ток ip носит название поляризационного тока, а электродвижущая сила е носит название электродвижущей силы П.
Явление электролитич. П. впервые доказано Риттером (1803), который обнаружил на опыте появление поляризационного тока от вольтметра, наполненного подкисленною водою с вставленными в нее золотыми электродами, когда этот вольтметр сначала соединялся с гальваническою батареею, а затем отделялся от батареи и соединялся с препаратом ножки лягушки. Взяв несколько металлических пластинок и наложив их одна на другую так, что между двумя пластинками помещалось смоченное сукно, Риттер приготовил "зарядный столб" (Ladungssaule). Когда этот "столб" соединялся с батареей из нескольких элементов и затем отделялся от нее, то на конечных пластинках столба получалось противоположное электричество. При прикосновении руками к обеим этим пластинкам наблюдатель испытывал особое физиологическое действие, он получал электрический удар. После заряда такого "столба" этот "столб" мог производить разложение воды, причем ток, получавшийся от него, имел направление, прямо противоположное тому току, который производил заряд столба. Особенно тщательно было изучено явление П. нашим покойным академиком Э. X. Ленцом. До опытов Ленца то значительное ослабление тока, которое наблюдается, когда в цепь вводится вольтметр, приписывалось возникновению на поверхностях, отделяющих электроды от жидкости, "сопротивления при переходе", т. е. высказывалось мнение, что в местах перехода тока из металла в жидкость и обратно ток встречает особое сопротивление w, вследствие чего при данной разности потенциалов VA — VB на электродах вольтметра, имеющего сопротивление r, сила проходящего через этот вольтметр тока должна выражаться формулой
i = (VA — VB)/(r + w) ...(4)
Э. X. Ленц показал своими опытами, что в рассматриваемом случае не "сопротивление при переходе" является причиною наблюдаемого значительного ослабления тока, а возникновение в вольтметре электродвижущей силы, действующей в направлении, прямо противоположном главной электродвижущей силе, т. е. той, которая возбуждает ток, проходящий через вольтметр, и что поэтому сила тока должна выражаться не формулою (4), а формулою (2). Дальнейшие опыты обнаружили, что электродвижущая сила П. электродов А и В в каком-либо вольтметре равна сумме электродвижущих сил П. того и другого электрода в отдельности, т. е. что
е = е A + е B
где е A и е B — численные величины тех разностей потенциалов, какие при прохождении тока через вольтметр наблюдаются на соответственных электродах (т. е. на А или на В) и в прилегающих к этим электродам слоях жидкости. Таким же электродвижущим силам е A и eB соответствуют поляризационные токи, которые получаются, когда после отделения вольтметра от батареи будет соединен электрод А или электрод В с третьим электродом того же вещества, как первые два, введенным в жидкость вольтметра и не бывшим раньше в соединении с батареей. Опыты показали, что электродвижущая сила П. вообще возрастает с увеличением силы поляризующего тока, но, однако, это возрастание достигает в данном вольтметре определенного предела, больше которого электродвижущая сила П. не получается, как бы ни увеличивалась сила тока, производящего электролиз. Всякому металлу, употребляемому как электрод в данном электролите, соответствует вполне определенная "наибольшая электродвижущая сила П.". Эта наибольшая П. лишь немного изменяется при изменении температуры жидкости, при изменении давления, под которым находится жидкость, и, наконец, при изменении характера поверхности металла. При электролизе подкисленной серною кислотою воды между платиновыми электродами являющаяся на том и другом электроде П. одинакова по величине, но противоположна по знаку. Полная наибольшая электродвижущая сила П. платиновых электродов в подкисленной воде более чем в 2—3 раза превышает электродвижущую силу элемента Даниеля. По наблюдениям Вюльнера и Коха (1894), эта наибольшая П. может доходить до 3,77 вольт. При очень малых размерах платиновых электродов (при электродах, представляющих собою концы очень тонких проволок, впаянных в стеклянные трубочки) наибольшая П. получается еще значительнее. Для медных электродов в подкисленной воде максимум П. составляет только 0,34 электродвижущей силы элемента Даниеля. Особенно малая П. наблюдается в случае электролиза цинкового купороса между электродами, приготовленными из амальгамированного цинка. П. даже почти вполне исчезает, когда раствор цинкового купороса совершенно свободен от кислоты. Причина явления П. при существовании электролиза заключается: 1) в том изменении электродов, какое они претерпевают, когда на их поверхности отлагаются продукты разложения электролита, и 2) в том изменении, какое вследствие электролиза претерпевают слои жидкости, соприкасающиеся с электродами. Когда при электролизе жидкости продуктами электролиза являются газы, то эти газы, даже не соединяющиеся химически с веществом электродов, тем не менее поглощаются последними, вследствие чего электроды и приобретают по отношению к жидкости электрические свойства, иные чем те, какими они обладают, когда не заключают в своей массе окклюдированных газов. Но такая П. газами быстро ослабевает после прекращения поляризующего тока, если выделявшиеся на электродах газы не образуют прочных химических соединений с веществом электродов. В данном случае после прекращения явления электролиза газы, поглощенные электродами, диффундируют из электродов обратно в жидкость. Напротив, П. сохраняется без изменения очень продолжительное время, если выделяющиеся при электролизе газы вступают с веществом электродов в прочное химическое соединение. На этом основано устройство особых поляризационных элементов, так называемых "аккумуляторов". Употребляемые ныне аккумуляторы состоят из погруженных в водяной раствор серной кислоты свинцовых пластин, из которых одни пластины, соединенные в одну систему, покрыты на своей поверхности слоем сурика, другие, также соединенные вместе в другую систему и помещенные каждая между двумя пластинами первой системы, имеют весьма разрыхленную поверхность. При прохождении через такой аккумулятор электрического тока по направлению от пластин первой системы к пластинам второй происходит выделение кислорода на поверхностях, покрытых суриком, и выделение водорода на поверхностях разрыхленного свинца. Выделяющийся кислород соединяется с суриком и переводит его в прочное соединение свинца с кислородом, в так называемую перекись свинца; выделяющийся водород поглощается разрыхленным свинцом и удерживается в массе последнего весьма долгое время. Вследствие этого электродвижущая сила поляризации такого вольтметра, т. е. электродвижущая сила аккумулятора, сохраняется без изменения в течение нескольких месяцев и по величине равняется приблизительно двум вольтам. При замыкании такого аккумулятора, т. е. при получении от него тока, происходит обратное химическое явление: перекись свинца раскисляется выделяющимся на ней водородом, водород же, поглощенный разрыхленным свинцом, соединяется с кислородом, который при прохождении тока через аккумулятор получается на поверхностях этих пластин. Когда вся перекись свинца на положительных пластинах перейдет в низшее окисление свинца, а водород, находившийся в окклюдированном состоянии внутри свинца отрицательных пластин, выделится из последних, аккумулятор теряет способность возбуждать в цепи ток, т. е. электродвижущая сила аккумулятора делается ничтожно малою. Чтобы вновь зарядить аккумулятор, достаточно пропустить сквозь него ток по тому же направлению, по которому ток проходил первый раз. От такого тока получаются опять перекись свинца на "положительных" пластинах и водород на "отрицательных". Различные существующие ныне типы аккумуляторов различаются друг от друга лишь способом закрепления массы сурика на свинцовых пластинах, т. е. формою, какую имеют эти пластины. Постоянство электродвижущей силы аккумуляторов и вместе с тем незначительное внутреннее сопротивление последних, так как размеры пластин могут быть большие, а расстояния между пластинами — очень малые, и представляет собою причину очень большого распространения аккумуляторов.
Из своих измерений электродвижущей силы П., вызываемой газами, отделяющимися на электродах вольтметра при прохождении через последний слабых поляризующих токов, Ф. Кольрауш пришел к заключению, что величина электродвижущей силы П. пропорциональна количеству выделившихся газов. Более поздние опыты Бартоли, произведенные в 1880 г., дали возможность установить эмпирическую формулу, связующую электродвижущую силу П. (е) с количеством протекшего через вольтметр электричества и с величиною поверхности того и другого электрода (s1 и s2). Эта формула следующая: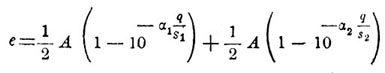
Здесь А, α 1 и α 2 — некоторыe постоянные, определяющиеся веществом электродов и электролита. Основываясь на законе Кольрауша, нетрудно рассчитать, какое нужно количество газов на электродах вольтметра, чтобы электродвиж. сила поляризации имела данную величину. Taк, для случая платиновых электродов в подкисленной воде следует, по формуле Кольрауша, что электродвиж. сила П. достигает величины электродвижущей силы элемента Даниеля тогда, когда на каждом квадратном сантиметре поверхности анода накопилось 12х10 -1 мг кислорода и соответственно этому на каждом квадр. сантиметре поверхности катода накопилось 15х10 -8 г водорода. Такие же малые количества дает для рассматриваемого случая и теория П., развитая Гельмгольцем и основанная на началах термодинамики. Итак, как опыты, так и теория показывают, что при соединении вольтаметра с источником тока нет необходимости во вполне заметном разложении электролита на его составные части, чтобы на электродах вольтметра обнаружилась П. П., впрочем, наблюдается и тогда, когда источник тока настолько слаб, что он не в состоянии вызвать даже следов электролиза. В этом случае вольтметр является вполне подобным системе двух конденсаторов, соединенных последовательно друг с другом. В самом деле, при сообщении электродов вольтметра с источником тока весьма малой электродвижущей силы является внутри жидкости вольтметра электрическая сила, под влиянием которой положительные ионы направляются к отрицательному электроду, т. е. к катоду, а отрицательные ионы направляются к положительному электроду, т. е. к аноду. Таким образом около обоих электродов вольтметра образуются слои ионов, заряженные противоположно электродам. Каждый электрод вместе с прилегающим к нему слоем ионов представит двойной электрический слой, т. е. явится совершенно подобным обыкновенному конденсатору. Поэтому, обозначая через С емкость такой пары конденсаторов, соединенных последовательно друг с другом, т. е. обозначая через С "емкость вольтметра", мы получаем для выражения разности потенциалов на электродах этого вольтметра, или для выражения электродвижущей силы П., являющейся в этом вольтметре, когда его электродам сообщено бесконечно малое количество электричества dq, следующую формулу:
de = dq/C = idt/C...(5).
Здесь dq = idt, если через i обозначена сила тока, проходящего через вольтметр, а через dt обозначен бесконечно малый промежуток времени, в продолжение которого проходил через вольтметр ток. Из формулы (5) получаем для электродв. силы П., являющейся в вольтметре при прохождении сквозь него конечного количества электричества, выражение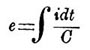 .
.
Если принять емкость вольтметра постоянной, то получается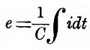 ,
,
т. е. закон Кольрауша. На самом деле емкость вольтметра не представляет собою величины вполне постоянной. Эта емкость изменяется, между прочим, в зависимости от количества газов, находящихся растворенными в жидкости вольтметра. Она изменяется также и от продолжительности заряжения вольтметра. Наименьшая величина емкости вольтметра, наполненного водяным раствором серной кислоты и имеющего электроды из платины, оказалась, по опытам проф. А. П. Соколова, равною 0,027 микрофарад для каждого квадр. мм поверхности электродов. Теория Гельмгольца, основанная, как уже упомянуто выше, на началах термодинамики, дает возможность для некоторых частных случаев вывести формулу для выражения электрод. силы П. Пользуясь двумя началами термодинамики, можно показать, что работа, совершаемая током при разложении некоторого количества электролита, должна равняться приращению свободной энергии системы тел, находящихся в вольтметре. Поэтому, обозначая через η электрохимический эквивалент данного электролита, через q — количество протекшего сквозь вольтметр электричества и через (F2 — F1) приращение "свободной энергии" в вольтметре, когда подвергается разложению весовая единица электролита, мы получаем для электролитической работы тока выражение q η (F2—F1). Но, с другой стороны, работа этого тока выражается через qе, если через е обозначается электродвижущая сила вольтметра. Итак, мы имеем qe = q η (F2 — F1)
отсюда получаем e = η (F2 — F1) ...(8).
Для электродвиж. силы П. платиновых электродов в воде, находящейся под давлением гремучего газа, выделяющегося при электролизе воды, Гельмгольц находит выражение
E = E0 + (10-7 η 0TRH/6)lgp ...(9).
В этой формуле величина E выражается в вольтах, η обозначает электрохимический эквивалент воды, соответствующий 1 кулону электричества, Т обозначает абсолютную температуру воды, RH — газовую постоянную водорода, т. е. постоянную, входящую в формулу Клапейрона для водорода (pv = RHT), p — давление гремучего газа, выраженное в атмосферах, lg обозначает натуральный логарифм. Нетрудно видеть, что Е 0 выражает электродв. силу П. в том случае, когда p = 1, т. е. давление гремучего газа равно 1 атмосфере. Диссоциационная теория растворов дает также возможность найти выражение электродв. силы П. Так, Нернст, основываясь на этой теории, вывел следующую формулу для электродв. силы П. одного электрода вольтметра:
EM = BTlg(P/p) ...(10);
здесь В обозначает некоторую постоянную, T — абсолютную температуру, P — "упругость растворения" (L ö sungstension) вещества электрода и p — осмотическое давление того же металла, находящегося в состоянии раствора в жидкости, прилегающей к этому электроду. Для двух электродов из одного и того же металла электродв. сила П. выражается формулою
E = BTlg(p2/p1)...(11).
Здесь p2 и p1 обозначают осмотические давления ионов того вещества, из которого приготовлены электроды, в слоях жидкости, прилегающих соответственно к тому и другому электроду. П. наблюдается и в гальванических элементах, в которых действием тока вызывается отложение газов на поверхностях твердых тел, входящих в состав элементов. Благодаря этой поляризации такие элементы являются непостоянными, т. е. их электродвижущая сила изменяется в зависимости от продолжительности действия элементов. Поэтому-то постоянные элементы и составляются обыкновенно из двух жидкостей, через что достигается уничтожение выделения газов при электролизе жидкостей.
И. Боргман.
| "БРОКГАУЗ И ЕФРОН" >> "П" >> "ПО" >> "ПОЛ" >> "ПОЛЯ" |
Статья про "Поляризация электрическая, или гальваническая" в словаре Брокгауза и Ефрона была прочитана 1504 раз
| Вкуснейшие куриные леденцы |
| Вкуснейшие куриные леденцы |
TOP 15
- Волос
- Проно
- Степные животные
- Гимнастика
- Индийский океан
- Архитектура
- Сравнение, в литературе
- Манда
- Клитры
- Колесование
- Испарение
- Травоядные животные
- Оплодотворение у pacтений
- Вредные насекомые
- Электризация тел