


БНБ
"БРОКГАУЗ И ЕФРОН" (121188)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Окислы азота
Определение "Окислы азота" в словаре Брокгауза и Ефрона
Окислы азота — С кислородом азот образует ряд соединений N 2O5 — азотный ангидрид [О над-азотной кислоте — см. Крепкая водка.], N 2O4 или NO 2 — азотноватый ангидрид или двуокись азота, N 2O3 — азотистый ангидрид, NO — окись азота, N 2 O — закись азота. Определения Фавра, Томсена, Бертело показали, что при образовании О. азота из азота и кислорода поглощаются следующие количества тепла: N 2O — 21, N2O2 — 43, N2O3 — 22, N2O4 — 5, N2O5 — 1. Числа эти (выражены в тыс. единиц тепла и вычислены для газообразного состояния) получены не из прямых наблюдений, а из сравнения теплот горения тел (уголь, фосфор) в О. азота и чистом кислороде (в первом случае выделится больше и именно настолько, насколько эти О. поглотили тепла при своем образовании; см. Термохимия). Образование О. азота из азота и кислорода наблюдается лишь при условии притока энергии извне: горении водорода, светильного газа, дерева в воздухе, т. е. реакциях, сопровождающихся выделением тепла; при пропускании электрических искр — так, индуктированный ток (65 вольт и 15 ампер, Крукс) дает пламя азота в кислороде (см. Горение).
Азотный ангидрид N2O5 и азотная кислота HNO3, — см. Крепкая водка.
Азотноватый ангидрид N2O4 и двуокись азота NO2. Чистый азотноватый ангидрид представляет бесцветные кристаллы, плавящиеся при 9° (Пелиго) в жидкость, окрашивающуюся при повышении температуры от бледно-желтого до бурого цвета; из этой жидкости кристаллы получаются лишь при охлаждении ниже —16° (Пелиго). Пары азотноватого ангидрида окрашены в бурый цвет, становящийся с повышением температуры все интенсивнее, при 140° теряется прозрачность; при охлаждении наблюдается обратное просветление. Определения плотности пара при различных температурах показали, что азотноватый ангидрид при повышении температуры распадается: N 2O4 = 2NO2, и чем выше температура, тем в большей мере совершается это распадение, при охлаждении же наступает обратная реакция: NO 2 + NO2 = N2O4. Сен-Клер Девилль и Трост показали, что плотность паров азотноватого ангидрида в пределах температуры 27°-135° меняется от 38 до 23 (по отношению к водороду) и выше этой температуры остается постоянной, а так как N 2O4 отвечает плотность 46, а NO 2 — 23, то очевидно, что при 135° и выше, когда плотность паров = 23, мы имеем только NO 2, при понижении же температуры диссоциированные частицы NO 2 будут соединяться, давая N 2O4, и каждой температуре будет отвечать своя равновесная система частиц N 2O4 и NO 2 (см. Диссоциация). Дальнейшие исследования подтвердили это объяснение явлений, происходящих с азотноватым ангидридом. Так, влияние понижения давления должно было сказаться тем, что оно способствовало бы образованию частиц менее плотных, занимающих больший объем, т. е. образованию NO 2, или, иначе выражаясь, должно было увеличить меру диссоциации, что и показали Л. и Г. Натансон. Из таблицы видно, что мера диссоциации — (отношение количества разложенного к количеству всего вещества) растет с уменьшением давления.
| Температура | Давление уменьшалось | x возрастало | x при 765 мм. |
| 0° 49,7° 100° | От 251 до 38 мм. От 498 до 27 мм. От 732,5 до 11,7 мм. | От 10 до 30 От 49 до 93 От 89,2 до 99,7 | 40,04 84,83 |
Уже в жидком азотноватом ангидриде часть диссоциирована и только в кристаллическом бесцветном веществе имеется не диссоциированный чистый азотноватый ангидрид N 2O4. Реакция разложения N 2O4 = 2NO2 сопровождается поглощением тепла (-13,0 кал., Бертело). Характерный спектр поглощения азотноватого ангидрида принадлежит частицам NO 2, так как он является одним и тем же, как при высоких температурах, при которых N 2O4 не существует, так и при низких (Брьюстер, Кундт, Жернез, Бель, Лук). Будучи окислом промежуточным, азотноватый ангидрид может быть получен как из высшей степени окисления — азотной кислоты, так и из низшей — окиси азота. Из азотной кислоты азотноватый ангидрид образуется при восстановлении ее действием олова: 4HNO 3 + Sn = H2SnO3 + Н 2 О + 2N 2O4, крахмала, мышьяковистого ангидрида As 2 О 3 и др. веществ, способных легко окисляться, отнимая кислород от азотной кислоты, но при этом N 2O4 не получается свободным от других окислов азота (NO, N 2 O). Лучше исходить из азотнокислого свинца, который при накаливании разлагается: 2Pb(NO 3)2 = 2PbO + 4NO2 + O2. Получающийся азотноватый ангидрид при охлаждении представляет бурую жидкость и трудно дает кристаллы. Из окиси азота NO азотноватый ангидрид получается наиболее чистым и прямо дает при охлаждении бесцветные кристаллы. Для этого 2 объема окиси азота и 1 объем кислорода, хорошо высушенные, проводятся в охлаждаемую трубку, где, смешиваясь, и соединяются 2NO + O 2 = 2NO2. С водой азотноватый ангидрид гидрата не дает, но тотчас же разлагается. Вообще во многих случаях азотноватый ангидрид, как промежуточный окисел, разлагается, образуя производные азотистого и азотного ангидридов. При действии воды на холоде: 2N 2O4 + Н 2 О = 2HNO 3 +N2O3 (Фричше). При действии крепкой H 2SO4 образует нитрозил-серную кислоту (SO 3 H)(NO)O и азотную HNO 3 (Лунге). BaO уже при обыкновенной температуре дает Ba(NO 2)2 и Ba(NO 3)2 (Дюлонг). Действие теплой воды в большом количестве дает исключительно НNО 3, но это происходит потому, что N 2O3 тотчас разлагается: 2N 2O3 = 2NO + N2O4, причем NO дает с кислородом N 2 О 4. Точно также и реакцию паров азотноватого ангидрида на бензольный раствор анилина, при которой получается азотнокислый диазобензол: C 6H5NH2 + N2O4 = C6H5N:N.NO3 + H2 O (Витт), можно приписать предварительному распадению 2N 2O4 на N 2O3 и N 2 О 5 [На эту реакцию указывают как на доказательство несуществования азотистого ангидрида (см. дальше), так как характерной реакцией для N 2O3 считается именно реакция диазотирования, а при этой реакции последнее производится как бы азотноватым ангидридом.]. С фосфорнокислым магнием, с хлористыми соединениями Sb, Bi, Fe и Al азотноватый ангидрид дает легко разлагающиеся двойные соединения (Бессон), например 3SbСl 5.2NО 3. Co и Cu с выделением тепла при обыкновенной температуре дают с парами N 2O4 легко разлагающиеся соединения Cu 2(NO2) и Co 2(NO2) (Сабатье и Сандеран). Азотноватый ангидрид разлагается с выделением свободного кислорода лишь при нагревании выше 500°, причем бурый цвет его пропадает (Ричардсон). В присутствии тел, способных окисляться, азотноватый ангидрид легко отдает им часть или весь свой кислород. Железо и медь при накаливании, цинк и ртуть при обыкновенной температуре разлагают пары азотноватого ангидрида, калий горит с красным пламенем; фосфор и уголь, зажженные, продолжают гореть. На основании реакций, при которых азотноватый ангидрид разлагается на N 2O3 + N2O5, его можно рассматривать как смешанный ангидрид азотистой и азотной кислот ON.O.NO 2.
Азотистый ангидрид N2O3. При —10° азотистый ангидрид представляет индигово-синюю жидкость, застывающую при —82° (Бирхаус), кипящую при 0° (Фричше, Поршнев). Уже в жидкости наступает разложение (Рамзай, Гейтер), в парообразном же состоянии N 2O3 вполне разлагается N 2O3 = NO2 + NO, на что указывает как определение плотности пара (Поршнев), так и то, что спектр поглощения бурых паров (немного менее интенсивного окрашивания, чем для NO 2), получающихся из N 2O3, тот же, что и у двуокиси азота NO 2 (Лук) [Некоторыми вовсе не признается существование и в жидком виде азотистого ангидрида. За существование азотистого ангидрида в жидком виде говорит то, что соли кислоты, отвечающей этому ангидриду, сравнительно весьма постоянны, указывают также на синий цвет и на то, что в N 2O4 растворяется окиси азота maximum (один из способов получения Н 2 О 3, см. дальше) столько, сколько требуется уравнением N 2O4 + 2NO = 2N2O3 (Поршнев). Возможно предположить, что и в этом случае мы имеем явление диссоциации и что реакция N 2 О 3 NO+NO2 обратима, но уже при обыкновенной температуре наступает полное разложение. Определение частичного веса по способу Рауля, указывает на это, так как получились значения 80,9-92,7 вместо требуемого 75,9 (Рамзай).]. Наиболее чистым получают жидкий азотистый ангидрид, смешивая предварительно хорошо высушенные 4 объема окиси азота и 1 объем кислорода и охлаждая до —20° (Реньо-Штрекер). Из N 2O4 получают азотистый ангидрид растворением NO при пропускании его в жидкий азотноватый ангидрид при сильном охлаждении N 2 О 4 + 2NO = 2N2O3 (Поршнев); также действуя на жидкий N 2O4: водой при охлаждении 2N 2O4 + H2O = N2O3 + 2HNO3 (Фричше). Из азотной кислоты получают N 2O3 восстановлением ее, для чего употребляется мышьяковистый ангидрид As 2O3, крахмал (Либих) и пр. Реакции, которые приписываются азотистому ангидриду в парообразном состоянии, должны быть отнесены к реакциям смеси NO и NО 2, обладающей способностью действовать окислительно. Одной из наиболее важных по практическому своему применению является реакция окисления сернистого ангидрида в серную кислоту (см. Камерное производство) [До позднейших исследований (Поршнев, 1895) в камерном процессе главную роль приписывали действию N 2O3 (Лунге), но теперь ввиду того, что доказано, что N 2O3 в газообразном состоянии и не существует, окислительную роль необходимо приписать именно смеси NO + NO 2, что и делает ныне Лунге, вводя в реакции, которыми он выражает камерный процесс, везде NO + NO 2 вместо N 2 О 3, например 2SO 2 + NO + NO2 + O2 + H2O = 2SO5 NH.]. Образующиеся при известных условиях в свинцовых камерах так называемые камерные кристаллы представляют соединение O. азота с серной кислотой SO 3 H(NO)O нитрозил-серную кислоту. Она образуется при взаимодействии различных О. азота (за исключением закиси азота) с О. серы в присутствии малого количества воды. Так, серная кислота крепкая и NO 2, дымящая азотная кислота и О 2 дают камерные кристаллы, плавящиеся при +76° с выделением воды и ангидрида (SO 2.NO2)2 O. При действии на них воды выделяются бурые пары О. азота и серная кислота. При действии SО 2 выделяется окись азота и серная кислота, но лишь в присутствии воды. В крепкой серной кислоте нитрозил-серная кислота растворяется без разрушения (т. е. без выделения O. азота) и чем крепче кислота, тем больше растворимость. Не наступает разрушения такого раствора даже при значительном нагревании. Нитрозил-серную кислоту рассматривают как производное серной и азотистой кислоты
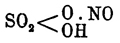 (смешанный неполный ангидрид) или как соединение по остаткам азотной и серной кислот HO.SO 2 — NO2.
(смешанный неполный ангидрид) или как соединение по остаткам азотной и серной кислот HO.SO 2 — NO2.Азотистая кислота HNO2 или гидрат азотистого ангидрида в чистом виде неизвестен; N 2 О 3 жидкий тонет в воде, при 0° довольно значительно растворяется, но при повышении температуры такой раствор разлагается: 3HNO 2 = 2NO + HNO3 + H2 O, окись азота выделяется из раствора (давая бурые пары на воздухе, так как NO + O = NO 2), a азотная кислота в нем остается. Только в очень слабых растворах и при низких температурах она обладает некоторым постоянством, но при действии порошковатых тел, как песок, гипс, уголь, выделяется N 2O3, который и разлагается (Фреми). Соли азотистой кислоты типа M'NO 2 или M"(NO 2)2 отличаются сравнительной прочностью при возвышенной температуре. Искусственно получаются сплавлением селитры со свинцом, т. е. восстановлением солей азотной кислоты: KNO 3 + Pb = PbO + KNO2; растворяя в воде KNO 2, двойным разложением (KNO 2 + AgNO3 = KNO3 + AgNO2) получают мало растворимую соль серебра. При восстановлении солей азотной кислоты амальгамой натрия, калия и цинка (Шёнебейн), при пропускании смеси NO + NO 2 (бурые пары, получающиеся, например, при действии крахмала на HNO 3) в растворе щелочей (Пелиго) образуются соли азотистой кислоты. Также действует и NO в присутствии кислорода или соединений, легко отдающих свой кислород — Ag 2O, H2O2 (Шёнебейн). NH 4NO2 очень легко разлагается, а при 70° взрывается и от удара: NH 4NO2 = N2 + 2H2 O. Кислоты (серная, уксусная) выделяют из солей азотистую кислоту, которая тотчас же распадается. При кипячении водного раствора соли разлагаются: 3MNO 2 + H2 О = MNO 3 + 2MOH + 2NO (Берцелиус). Известны соли М 3NO3 и М 4N2 О 6, отвечающие неизвестным орто— N(OH) 3 и пиро— N 2(OH)4 O гидратам азотистой кислоты. О распространении и образовании азотистой кислоты в природе см. Крепкая водка, Селитра. Как промежуточный окисел, азотистая кислота способна к дальнейшему окислению (например при действии Н 2 О 2, KMnО 4), переходя в азотную кислоту и действуя, таким образом, восстановительно (восстанавливает золото из AuCl 3), но особенно характерны для неё реакции окисления: йодистый калий окисляется с выделением йода (синее окрашивание крахмального раствора), мочевина окисляется: СО(NН 2)2 + N2 О 2 = СО 2 + 2Н 2 О + 2N 2 (Миллон), SO 2 окисляется в серную кислоту, аммиак окисляется в воду и азот: NН 3 + НNО 2 = N2 + 2Н 2 О. Реакции на органические соединения не ограничиваются одними реакциями окисления: азотистая кислота дает сложные эфиры (см.), нитро— и нитрозосоединения (см.), изонитрозосоединения (см.), диазосоединения (см.). Последняя реакция, при которой из бесцветных соединений получаются окрашенные, употребляется для качественного определения азотистой кислоты: так, сернокислый дифениламин окрашивается в голубой цвет, сернокислый метафенилендиамин — в желтый, сульфанидовая кислота с H 2SO4 по прибавлении α-нафтиламина дает с азотистой кислотой розовое или красное окрашивание (определяется присутствие 0,01 гр. HNO 2 в 1 куб. метре воды). Количественное определение азотистой кислоты (также N 2O4 и NO) производится, как и определение азотной кислоты, в нитрометре (см.) или же окислением KMnО 4. Избыток KMnО 4 титруется обратно щавелевой кислотой (или железным купоросом).
Окись азота NO — бесцветный газ; плотность по отношению к воздуху 1,041 (Томсон), 1,094 (Дэви). При —11° и 104 атмосферах давления сгущается в бесцветную жидкость с температурой абсолютного кипения —93°. Получается из высших степеней окисления азота: восстановлением азотной кислоты медью (8HNO 3 + 3Cu = 4H2O + 3Cu(NO3)2 + 2NO), также ртутью, серебром, солями закиси железа, при разложении водой N 2O4 (2N2O4 + H2O = 2HNO3 + 2O). Но так как при этих реакциях одновременно с NO образуются и другие О., то для очищения от высших степеней окисления пропускают получающиеся газы через крепкую серную кислоту, в которой эти высшие О. растворяются, а от закиси азота растворением NO в FeSO 4, откуда окись азота обратно выделяется при повышении температуры. Но и при этом все-таки получается окись азота с содержанием закиси (см. дальше), а потому для получения совершенно чистой окиси азота прибегают к следующему способу. В Вульфову двугорлую склянку наливают крепкой серной кислоты и прибавляют 5% по весу камерных кристаллов, затем через воронку с краном приливают металлической ртути и выделяющиеся газы пропускают через крепкую серную кислоту (Поршнев). Вместо камерных кристаллов можно употреблять азотистокислый натр NaNO 2. Окись азота растворяется в воде, по Генри, весьма мало (при 20° 100 объемов воды — 5 об. NO) [По Дэви, 100 объемов воды растворяют 10 объемов NO, а по новейшим данным Бунзена 100 объемов воды при 20° растворяют 26,573 объемов, и при 2° — 30,895 объемов NO.]. В спирту абсолютном растворяется весьма значительно (Кариус). Окись азота поглощается растворами многих кислот и солей, особенно растворами солей закиси железа, образуя весьма нестойкие соединения, выделяющие окись азота при нагревании или при пропускании струи водорода. В зависимости от температуры окись азота поглощается в количествах, соответствующих следующим формулам (Gay): до +8° — 3FeSO 4 +2NO; до +25° — 4FeSO 4 +2NO; выше +25° — 5FeSO 4 +2NO. При нагревании такого раствора, окись азота отчасти восстановляется в закись азота N 2 O (Винклер). Как О. промежуточный, окись азота может или окисляться, переходя в NO 2, N2O3 и HNO 3, или же восстановляться, переходя в закись азота N 2 O, в гидроксиламин NН 3 О, в свободный азот N 2, или в аммиак NH 3. Окись азота прямо соединяется с кислородом, результатом чего, при достаточном количестве кислорода, будет азотноватый ангидрид, при недостатке же образуется смесь NO + NO 2, дающая при охлаждении жидкий азотистый ангидрид N 2O3. Реакция 2NO + O 2 = 2NO2, идущая очень легко и с выделением большого количества тепла (38 тыс. калорий), в присутствии окислителей идет еще легче и сопровождается часто взрывом (например Cl 2O + NO = NO2|Cl2), причем если в реакции участвует вода, образуются азотная кислота или ее соли. Так действуют Н 2 О 2, PbO2, Ag2O, KMnO4 и Au 2O3, причем они, отдавая свой кислород, восстановляются или до металлов (например Ag, Au), или же в низшие степени окисления. NO является, таким образом, восстановителем. Окись азота, по наблюдениям Бертело разлагается лишь при нагревании выше 520° согласно равенствам: 2NO = N 2 + O2 и 2NO = N 2 O + O, a так как остающаяся неразложенной окись азота тотчас же соединяется с кислородом 2NO + O 2 = 2NO2, то и наблюдается при этом разложении образование бурых паров двуокиси азота. Полное разложение наступает только при температуре плавления платины; при 520°, по Бертело, преобладает образование закиси азота. Реакция разложения 2NO = N 2 + O2 должна выделять 43,4 кал., а потому некоторые тела горят в окиси азота более энергично, чем на воздухе, но горение в окиси азота отличается от горения в чистом кислороде тем, что гореть способны в окиси азота лишь те тела, температура горения которых достаточно высока для того, чтобы вызвать разложение окиси азота; так, зажженный фосфор продолжает гореть, а сера и уголь тухнут в окиси азота, но тот же уголь, если его предварительно накалить сильно, продолжает гореть. При накаливании в атмосфере окиси азота Zn, Cd, Cu, Fe, Pb покрываются слоем окислов, низшие степени окисления переходят в высшие; SnO, Ti 2O3, Мо 2 О 3, WoO2, UО 2 в SnO 2, Ti2O5, МоО 2, Wo2O5 и U 2O5; сама NO при этом переходит в закись азота N 2 O, или же выделяет свободный азот N 2.
Закись азота N2 О [О применении в медицине — см. ст. Закись азота.] — бесцветный газ, сладковатого вкуса, сгущающийся при 40 атмосферах и 15° в бесцветную жидкость, кипящую при —87,9° (Реньо) и под колоколом воздушного насоса при —115° (Натерер), причем переходит частью в снегообразную массу, частью в прозрачные кристаллы; смесь жидкой закиси азота с сероуглеродом кипит при уменьшенном давлении при —140° [Потому закись азота употребляется при работах, где надо получать низкие температуры.]. Удельный вес газа при 10° 1,52638, при 100° — 1,52336 (Думрейхер). N 2 O непосредственно из N и O не получается и единственный, почти, путь получения есть восстановление высших степеней окисления азота, например азотной кислоты (удельн. вес 1,217) медью, цинком и другими металлами, NO при действии H 2 S, Zn или Fe и т. д. Обыкновенно N 2 O получается при разложении (NH 4)NO3, совершающемся при 170°-260° согласно уравнению: (NH 4)NO3 = N2O + 2H2 O. Разложение производится в реторте при осторожном нагревании, в противном случае может произойти взрыв. В воде растворяется закись азота весьма значительно (при 0° в 100 объемах воды 130 объемов N 2 O, Кариус). Кислой реакцией раствор не обладает. Закись азота растворяется в спирте, эфире, летучих и жирных маслах. Закись азота, как при непосредственном действии кислорода, так и действием окислителей не переходит в высшие степени окисления азота и вообще отличается значительной инертностью. Ни с натристой известью (при темно-красном калении), ни с KOH в водном (до 3 00°) или спиртовом (до 200°) растворах N 2 О не соединяется (Бертело). По Гантчу, при действии KOH отчасти наблюдается образование азотистой кислоты и NH 3 (как нитрид азотной кислоты, N 2 О должна была при этом дать азотную кислоту и NН 3). Действием жара N 2 O разлагается трудно, при 520° разложение наступает в очень малой степени (1,5%), но при пропускании через накаленную трубку или при действии ряда электрических искр наступает разложение на N 2 и O, а потому и тела, зажженные и обладающие высокой температурой горения, продолжают гореть в закиси азота даже более энергично, чем на воздухе; так, фосфор, уголь, зажженные, продолжают гореть; но тот же фосфор может быть расплавлен в закиси азота и только при прикосновении к нему раскаленного добела (но не докрасна) железа зажигается. Вообще в закиси азота тела горят гораздо легче, чем в окиси азота. K и Na при незначительном нагревании, а Fe при сильном накаливании сгорают; Sn, Zn, Mn окисляются при накаливании. Точно также и вещества легко окисляющиеся, как Н 2, H2S, РН 3, СО и др., отнимают от закиси азота кислород, и смеси их при возвышенной температуре или при действии электрической искры взрываются. При всех этих реакциях освобождается N 2, a при избытке закиси азота наблюдается и свободный кислород (Пристлей, Тенар), что указывает на предварительное распадение закиси азота на N 2 = O; на это предварительное распадение указывает и то, что при некоторых реакциях наблюдается образование HNO 3, но именно при тех же условиях, при которых может образоваться из свободных N 2 и О 2 окись азота, которая дальше и переходит в азотную кислоту при действии кислорода и воды, так, например, наблюдается образование HNO 3 при пропускании смеси H и N 2 O через губчатую платину (Доберейнер). Весьма интересной является реакция закиси азота с амидом натрия NaNH 2, так как при ней закись азота образует соль азотистоводородной кислоты HN3, по уравнению: N 2 О + H 2NNa = H2O + NaN3 (В. Вислиценус) [Азотистоводородная кислота N3 H получена впервые Курциусом (1890) при разложении щелочами бензоилазоимида: C6H5CO.N3 + NaHO = C6H5CO.OH + NaN3. Затем Курциусом же азотистоводородная кислота получена из диазоимида гиппуровой кислоты. Из гидразина H 2N-NH2 азотистоводородная кислота получается действием (Курциус) окислов азота (N 2O3) или же при действии на сернокислый гидразин насыщенного раствора азотистосеребряной соли (Анжели). Из закиси азота и амида натрия (В. Вислиценус) — см. в тексте. Из диазогуанидина при действии KOH — см. Нитрогуанидин. Свободная кислота выделяется из получающихся при вышеуказанных реакциях солей серной кислотой. Безводная N 3 H — прозрачная, весьма подвижная жидкость, кипит при 37°, в воде хорошо растворима, ядовита, обладает нестерпимым едким запахом, действует разъедающим образом на кожу и слизистые оболочки; представляет вещество весьма нестойкое, так что уже при обыкновенной температуре происходят взрывы. В водном растворе азотистоводородная кислота постоянна, обладает сильнокислой реакцией; электропроводность ее больше чем уксусной кислоты (Оствальд). Теплота нейтрализации для Ba(НО) 2 = 10,0К, для KН 3 = 8,2К (Бертело). По своим свойствам азотистоводородная кислота очень сходна с хлористоводородной (за исключением взрывчатости), одноосновна, дает соли типа М'N 3 или M"N 6, очень взрывчатые; соли серебра и закиси ртути нерастворимы в воде; Mg, Sn, Al, Fe, Cu выделяют из HN 3 водород. Из солей получены: NaN 2 — кристаллична, растворима в воде; NH 4N3 — призматические кристаллы, плавится при 50°, при осторожном нагревании возгоняется; теплота образования выведенная из теплоты горения 25,3К (твердая NH 4N3) (Бертело). BaN 6 блестящие кристаллы; AgN 3 призмы, плавящиеся при 250°, растворяется в NH 3, на свету не изменяется. Hg 2N6 белый кристаллический осадок; (N 2H4)HN3 — соль гидразина, из воды кристаллизуется в блестящих призмах (до 1 дюйма длиной), из спирта в виде пластинок; плавится при 50°. Способ получения азотистоводородной кислоты из закиси азота указывает на связь азотистоводородной кислоты с азотной кислотой, так как, рассматривая закись азота как нитрид, происшедший выделением воды из одноаммиачной соли ортоазотной кислоты, можно и азотистоводородную кислоту рассматривать как нитрил, но происшедший выделением воды из двуаммиачной соли H(NH 4)2NO4 — 4H2O = N3 H, а так как водород азотистоводородной кислоты тот же, что и в азотной кислоте, то он и сохранил способность замещаться металлами (Менделеев). По теории строения, азотистоводородной кислоте придают формулу
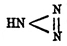 (Курциус), т. е. рассматривают как азо-имид, так как он получается из соответствующих органических соединений.]. На основании того, что N 2 O непосредственно из N 2 и О 2 не получается, а получается лишь из высших окислов, возможно рассматривать закись азота как нитрил азотной кислоты, что и отвечает реакции получении NH 4NO3 — 2H2O = N2O.
(Курциус), т. е. рассматривают как азо-имид, так как он получается из соответствующих органических соединений.]. На основании того, что N 2 O непосредственно из N 2 и О 2 не получается, а получается лишь из высших окислов, возможно рассматривать закись азота как нитрил азотной кислоты, что и отвечает реакции получении NH 4NO3 — 2H2O = N2O.Азотноватистая кислота H2N2O2 в чистом состоянии получена лишь недавно (1896). В виде солей и эфиров была получена впервые в 1871 г. Для получении свободной кислоты — в раствор хлористого водорода в эфире вносится при охлаждении азотноватисто-серебряная соль небольшими количествами, осадок хлористого серебра отфильтровывается и эфир испаряется, по возможности быстро, в эксикаторе над серной кислотой и едким кали; получается свободная азотноватистая кислота в виде белых кристаллов, весьма быстро разлагающихся (Гантч). В водном растворе азотноватистая кислота более постоянна, но при долгом стоянии или при действии сильных кислот разлагается с выделением свободного азота и образованием азотистой и азотной кислот. Свободная кислота окрашивает в синий цвет крахмальный раствор с йодистым калием, а с другой стороны действует и восстановительно, например на KМnО 4. Кислотными свойствами азотноватистая кислота обладает весьма слабыми, с фенолфталеином титруется только 1/2 свободной кислоты; электропроводность незначительна (при t = 0 и растворении грамм-молекулы в 64 литрах воды μ = 3). Частичный вес, определенный криоскопически, оказался отвечающим формуле H 2N2O2 (Гантч). Азотноватистая кислота двухосновна, образует средние эфиры (R 2N2O2) и соли, как средние (M 2'N2O2), так и кислые (M'HN 2O2) (Цорн). Соли получаются восстановлением натриевых солей азотной или азотистой кислот в водном растворе амальгамой натрия (Дайверс), или же при электролизе азотистокислых солей, употребляя ртуть как отрицательный полюс (Цорн). Нейтрализовав в первом случае уксусной кислотой, осаждают азотнокислым серебром азотноватисто-серебряную соль Ag 2N2O2, желтого цвета, нерастворимую в воде. В слабых кислотах, а также в NН 3 и (NH 4)2CO3 соль эта растворяется и из растворов выделяется обратно щелочами или кислотами; крепкими кислотами разлагается с образованием N 2, HNO2 и HNO 3. При 150° сухая соль разлагается с взрывом, при осторожном нагревании образуются Ag, AgNO 3 и NO. Кислая аммиачная соль NH4HN2O2 получается при пропускании сухого аммиака в эфирный раствор свободной кислоты; белые кристаллы, плавятся с разложением при 64-65° (Гантч), в водном растворе разлагаются. Эфиры этиловый (С 2 Н 5)2N2 О 2 (Цорн) и бензиловый (C 6H5.CH2)2N2O2 (Гантч) получаются при действии на Ag 2N2O2 йодистых этила или бензила, например: 2С 2H5I + Ag2N2 О 2 = 2AgI + (C2H5)2N2O2. По своему составу, азотноватистая кислота представляет соединение закиси азота с водой N 2O2H2 = N2O + H2 O, но из закиси азота не получена. С точки зрения теории замещения азотноватистую кислоту можно рассматривать происшедшей из однозамещенной аммиачной соли ортоазотной кислоты с выделением двух частиц воды, т. е. как нитрил или имид ортоазотной кислоты: H 2NH4SO4 — 2Н 2 О = N 2 (OH), или NO(NH)(OH). С точки зрения теории строения, азотноватистой кислоте может быть придано строение НО-N=N-ОН.
В. В. Мамонтов. Δ .
| "БРОКГАУЗ И ЕФРОН" >> "О" >> "ОК" >> "ОКИ" |
Статья про "Окислы азота" в словаре Брокгауза и Ефрона была прочитана 6028 раз
| Бургер двойного помола |
| Пицца в чугунной сковородке |
TOP 15
- Волос
- Проно
- Степные животные
- Гимнастика
- Индийский океан
- Архитектура
- Сравнение, в литературе
- Манда
- Клитры
- Колесование
- Испарение
- Травоядные животные
- Оплодотворение у pacтений
- Вредные насекомые
- Электризация тел