


БНБ
"БРОКГАУЗ И ЕФРОН" (121188)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Медь
Определение "Медь" в словаре Брокгауза и Ефрона
Медь (хим.) Сu (от лат. Cuprum), атомный вес около 63,3. — По некоторым археологическим данным М. была хорошо известна египтянам еще за 4000 лет до Р. Х. Знакомство человечества с М. относится к более ранней эпохе, чем с железом; это объясняется, с одной стороны, более частым нахождением М. в свободном состоянии на поверхности земли, а с другой — сравнительной легкостью получения ее из соединений. Древняя Греция и Рим получали М. с о-ва Кипра (Cyprum), откуда и название ее Cuprum. М. в значительной степени распространена в природе. В свободном состоянии она встречается в россыпях; попадаются самородки М. до 430 тонн весом. Из соединений М. в природе распространены, главным образом, сернистые, содержащие, кроме М., обыкновенно Fe, Ag, As, Sb, напр. медный блеск Сu 2 S, медный колчедан, халькопирит CuFeS 2, пестрая медная руда Cu 3FeS3, CuAgS и пр. Из кислородных соединений встречаются Сu 2 O — куприт (красная медная руда), CuO — черная медная руда; кроме того, встречаются различные медные соли: угольной кислоты, напр. малахит СuСО 3 Cu(НО) 2, медная лазурь 2СuСО 3.Сu(HО) 2; серно-кислые, напр. CuSO 4 + 5H2 O; силикаты, напр. CuSiO 3 + 2H2 O — хризоколь, CuSiO 3 + Н 2 O — диоптаз; мышьяковые соли, напр. 4CuO.2As 2O5 — оливенит, фосфаты и пр. Вода некоторых минеральных источников содержит в растворе медные соли, напр. Теплиц, Висбаден и пр. М. встречается в золе некоторых растений, напр. в табаке; наконец, ее находят в метеоритах.
Физические свойства М. Присутствие ничтожных следов примесей сильно изменяет свойства М., и этим объясняется различие относящихся сюда данных. В отраженном свете М. ярко-красного цвета, в очень тонких листочках она просвечивает зеленым цветом. Кристаллизуется М. в формах правильной системы, обыкновенно в виде кубов. Удельный вес ее сильно меняется в зависимости от происхождения и обработки, например (при обыкновенной температуре) для природных кристаллов М. он равен — 8,94; для М., гальванопластически осажденной — 8,91; для М. плавленной — 8,921; кованой — 8,952. Сравнительно небольшой удельный вес плавленной М. объясняется способностью ее в жидком состоянии поглощать газы, которые, выделяясь при затвердевании, делают массу пористой; проковкой эти поры уменьшаются. Температура плавления дается разная — от 1330° до 1050°, последняя наиболее вероятна. Коэффициент расширения (линейный) ок. 0,000018; кубический — 0, 0000565 — 0,0000518 (Копп). Теплоемкость М. (от 0° до 100°), по Реньо — 0,09515 — 0,9332 (Томлинсон), от 0° до 360° — 0,104 (Леверье), М. в слабой степени диамагнитна. Электропроводность М. твердой 99,95; мягкой 102,21 (для серебра 100). Тягучесть и ковкость ее сильно зависят от примесей. После железа — это наиболее вязкий металл. Для разрыва проволоки 1 кв. мм сечения принимается груз 45 — 60 кг. По ковкости она лежит между серебром и оловом. Спектр М. имеет ярко-зеленые линии с длиной волны 5107, 5153, 5 2 17; для получения его лучше всего делать разряд между медными электродами, так как спектр медных солей, например хлористой, бромистой М. и пр. усложняется присутствием галоида и получается несколько иной.
Химические свойства. М. при обыкновенной температуре и в сухом воздухе не изменяется; во влажном воздухе она покрывается слоем окислов, которые с СО 2 образуют углекислые соли. При нагревании на воздухе, в зависимости от количества последнего и температуры, М. дает окись CuO или закись Cu 2 O. Воды М. не разлагает ни при какой температуре и из кислородных кислот не выделяет водорода. Растворение М. в этих кислотах или требует присутствия кислорода воздуха, или идет в две фазы; в первой фазе М. окисляется за счет кислорода кислоты, причем выделяются различные продукты восстановления последней; во второй фазе образовавшийся окисел М. с избытком кислоты дает соль. Крепкая азотная кислота делает М. пассивной, подобно железу, слабая растворяет с выделением окиси азота, напр. 3Cu+8HNO 3=3Cu(NO З)2 +2NO+4Н 2 O (ср. соотв. статью). При растворении М. в серной кислоте происходит сложная реакция. По Пиккерингу, кроме главной реакции Cu+2H 2SO4=CuSO4+SO2+2H2 O раскисление идет еще дальше, и сернистого газа не получается, а выделяется полусернистая М.: 5Cu+4H 2SO4=3CuSO4+Cu2S+4H2O. Последняя реакция идет тем лучше, чем ниже температура. При нагревании Cu 2 S может растворяться в H 2SO4, причем выделяется сера и водород. Соляная кислота растворяет М. при нагревании с выделением водорода. То же производит и крепкая йодисто-водородная. Растворы солей, в особенности аммиачных, более или менее действуют на М. Водный аммиак в присутствии кислорода растворяет М.; полученный раствор обладает способностью растворять клетчатку. М. прямо соединяется с хлором, бромом, йодом, серой и пр. В сухом хлоре тонкий листочек М. воспламеняется при обыкновенной температуре. М. с другими металлами образует многочисленные сплавы и со ртутью дает легко амальгаму. Многие из сплавов М., например с цинком, оловом, свинцом, серебром, золотом, алюминием имеют громадное значение для техники (см. Бронза, Латунь, Монетные сплавы, Мельхиор, Томпак и пр.). Для получения чистой М. или выделяют ее электролитическим путем, или восстановляют водородом из окиси.
Соединения М. Для М. известны, главным образом, два вида соединений: CuX — соединения закисные и СuХ 2 — окисные (X — одноатомный элемент или одноатомная группа). Занимая в периодической системе место в одном ряду с золотом и серебром, М. представляет с ними много общего в характере соединений; в особенности закисные соединения М. представляют много общего с соединениями окиси серебра, например природная Cu 2 S — изоморфна с Ag 2 S, CuCl, подобно AgCl, не растворима в воде и растворяется в аммиаке; CuJ сходно с AgJ по нерастворимости в воде и плохой растворимости в NH 3; Cu2SO4 подобно Ag 2SO4 плохо растворима в воде и пр. С водородом М. дает Cu 2 Н 2 — водородистую М. Она получена Вюрцем при восстановлении медного купороса фосфорноватистой кислотой при нагревании. Cu 2 Н 2 — вещество бурого цвета, во влажном виде постоянно на холоде, разлагается при 55°; с НCl оно выделяет водород: Cu 2 Н 2+2HCl=Cu2Cl2+2H2; в хлоре воспламеняется. Поггендорф указывает на образование водородистой М. при электролизе медного купороса слабым током, а Шютценбергер при восстановлении его сернисто-кислым натрием. С кислородом известно несколько соединений М. Cu 4 О, Cu 2 О, CuО, CuО 2. Квадратная окись М. Cu 4 О получается при восстановлении гидрата окиси M. Cu(HО) 2 хлористым оловом в щелочном растворе, представляет вещество малопрочное, на воздухе легко окисляется, соответственных солей не образует и при растворении в кислотах дает соли закиси или окиси М. с выделением металлической М., например: Cu 4 О+2НСl=Сu 2Cl2 +2Сu+Н 2 O. Закись M. Cu 2 О встречается в природе в виде октаэдров или кубов красного цвета (куприт). Для получения еe существует много способов. Она получается при прокаливании окиси М. CuО с металлической M.: CuO+Cu=Cu 2 О или полухлористой M. Cu 2 Сl 2 с содой, по уравнению: Cu 2 Сl 2+Na2CO3=Cu2O+2Na2 Сl+CO 2 и в особенности при раскислении солей окиси М. в присутствии различных органических веществ в щелочном растворе. Удобнее всего поступать так: к медному купоросу прибавляют достаточное количество винной кислоты и избыток щелочи (образуется двойная соль, растворимая в щелочи), кладут затем патоку и нагревают. Сначала выделяется малоизвестный гидрат закиси, который переходит в Cu 2 O. Она получается также прямо при продолжительном кипячении муравьиной или уксусной соли М. и пр. Закись М. на воздухе постоянна, она растворяется в NH 3 и дает бесцветный раствор, легко окисляющийся и при этом синеющий; при сплавлении она окрашивает стекло, буру, фосфорно-натриевую соль в красный цвет, что служит для качественного распознавания М. Закиси М. соответствуют соли, которые вообще бесцветны, легко окисляются и пр. Наибольшую практическую важность из кислородных соединений представляет окись М. CuO, которая играет большую роль при органическом анализе. Она получается при прокаливании металлической М. на воздухе (при избытке кислорода) и солей (азотно-кислой, углекислой и пр.), а также гидрата окиси М. Указывают, что CuO, полученная из азотно-медной соли, удерживает в значительном количестве азот (на 1 г до 1,5 куб. см), который выделяется в пустоту; это нужно иметь в виду при употреблении CuO для анализа. В порошке CuO очень гигроскопична; при очень сильном накаливании она выделяет кислород и дает низшие окислы М. В вольтовой дуге (в электрической печи Муассана) она разлагается на М. и кислород. Водород, уголь, органические вещества при накаливании легко сжигаются за счет кислорода окиси М., на этом основывается применение ее для анализа. CuO при сплавлении дает зеленые стекла. Из солей, отвечающих окиси М., едкие натр или кали на холоде выделяют гидрат Сu(НО) 2 голубого цвета. Он малопрочен при хранении при обыкновенной температуре и еще легче при нагревании выделяет воду и дает CuO, в крепких щелочах (NaНО и КНО) немного растворяется, легко растворяется в аммиаке и дает известный Швейцеров реактив (см. Волокна растений, Инкрустирующее вещество, Клетчатка). Гидрат окиси М. служит для приготовления красок. Двуокись М. CuO 2 получена Тенаром при действии перекиси водорода на гидрат окиси М. или на азотно-медную соль Cu(NO 3)2 со щелочью, бурое вещество, легко разлагающееся при нагревании; аммиачный раствор медного купороса с перекисью водорода дает CuO2H2 O. При сплавлении М. с селитрой и КНО или CuО с хлорноватисто-кислыми солями Фреми получил щелочные соли медной кислоты (вероятно CuO 3), растворимые в воде, малопрочные, разлагающиеся с выделением кислорода. Указывают на существование других окислов, напр. Cu 3O, Cu3 О 2, Cu5 О 3 и пр., но они мало изучены. Хлористых соединений известно два, Cu 2Cl2 и CuCl 2. Полухлористая M. Cu2Cl2 получается при действии хлора на накаленную М. в избытке, при растворении Cu 2 О в соляной кислоте без доступа воздуха и во многих случаях при восстановлении растворов CuCl 2; так действует, напр., металлическая М., но в особенности удобен сернистый газ SO 2 или сернисто-кислые соли, например:
2CuCl2 + SO2 + 2H2O = Cu2Cl2 + H2SO4 + 2НCl.
Подобным же образом Cu 2Cl2 получается при восстановлении CuCl 2 хлористым оловом, фосфорноватистой кислотой и пр. или прямо при накаливании СuCl 2. Полухлористая М. не растворима в воде, растворяется в растворе поваренной соли, в соляной кислоте и аммиаке дает бесцветный раствор. Как сама Cu 2Cl2, так в особенности ее растворы легко окисляются на воздухе и синеют. Растворы в НCl и NH 3 поглощают окись углерода и употребляются в газовом анализе для ее определения. Аммиачный раствор поглощает также ацетилен, а соляно-кислый — фосфористый водород Н 3 Р. Cu 2Cl2 дает двойные соединения с NН 4 Cl, КСl, BaCl 2, CuO и NH 3. Хлористая M., CuCl2, безводная получается при действии хлора в избытке на М. или Cu 2Cl2 при нагревании; водная — при растворении CuO или CuСО 3 в соляной кислоте. CuCl 2 при кристаллизации из водных растворов дает гидрат CuCl 2 2Н 2 О. При растворении CuCl 2 в воде при обыкновенной температуре цвет получается различный, в зависимости от концентрации (от темно-зеленого до синего); это объясняется образованием разных гидратов (CuCl 2 + 7Н 2 О для зеленого и CuCl 2 + 12H2 O — для синего раствора). То же изменение цвета происходит для некоторых растворов и с изменением температуры. Растворимость CuCl 2 в воде при прибавлении соляной кислоты сначала уменьшается, а потом увеличивается, как бы указывая на переход одних гидратов в другие. CuCl 2 дает двойные соединения с КCl, NH 4ClNH3 и пр., в особенности существует много соединений с CuO — так наз. хлорокиси М. Известны соединения с 1, 2, 3, 4, 6 CuO; они являются обыкновенно в виде гидратов; некоторые из них встречаются в природе, например CuCl 2.3CuО + 7НО 2 (атакамит). Получаются они при неполном осаждении CuCl 2 щелочью. Бромистых соединений тоже два: Cu 2Br2 и CuBr 2. Полубромистая M. Cu 2Br2, подобно Cu 2Cl2, получается при накаливании CuBr 2 или металлической М., взятой в избытке, в парах брома; в воде также не растворима и также растворяется в HBr, HCl, NH 3 и пр. CuBr 2 по способу получения и по свойствам напоминает CuCl 2. Из йодистых соединений Cu 2J2 наиболее постоянно. Оно получается при нагревании М. в парах йода, при растворении М. в HJ; при осаждении растворимых солей окиси М. йодистым калием; при этом выделяется свободный йод, например 2CuSO 4+4KJ=Cu2J2+2K2SO4+J2. Йода выделяется столько, сколько соединилось с М. Эта реакция настолько характерна, что предложена для определения М. титрованием. Cu 2J2 не растворима в воде, растворяется в NH 3, KCN, Na2S2O3 и кислотах. CuJ 2 вещество очень непрочное, существует только в слабых растворах и известно в соединении с NH 3. Со фтором М. дает Cu 2F2 и CuF 2; первое получается растворением Cu 2 O в HF и представляет вещество, не растворимое в воде и слабой HF; второе получается при действии HF на CuO или CuСО 3. В воде CuF 2 плохо растворимо, дает легко двойные соединения с KF, Al 2F6, SiF4, BF3 и пр. При нагревании порошкообразной CuО при 250° в токе NH 3 получается азотистая M. Cu6N2, взрывающаяся при нагревании до 300°. Фосфор и мышьяк во всех пропорциях соединяются с М.; указывают, однако, и на существование определенных соединений, например Cu 2P2, Cu3P2, Cu6As2 и проч. То же можно сказать и относительно кремния, присутствие его увеличивает твердость М.; при содержании его около 50% получается М. твердая, как сталь, и очень ломкая. Из соединений с серой известны, главным образом, два: Cu 2 S и CuS, оба встречающиеся в природе. Cu 2 S получается при сплавлении М. с серой, при сдавливании смеси Cu и S в порошке или растирании с водой, при накаливании CuS или CuSO 4 в струе водорода и пр. Это вещество черного цвета, окисляющееся на воздухе, плохо растворимое в НCl, с HNO 3 переходящее в CuS. При очень сильном накаливании водород восстанавливает его; при сплавлении с CuO получается металлическая М. или Cu 2 O, смотря по пропорции CuO. Cu 2 S образует двойные соединения с сернистыми металлами, встречающиеся в природе, напр. с железом Cu 2S.Fe2S З (халькопирит) и целый ряд соединений, где процентное содержание S, Fе и Сu очень меняется; с сурьмой известно Cu 2S.Sb2S3 — халкостибит и пр. CuS получается, главным образом, при осаждении медных солей (окиси) сероводородом или сернистыми щелочами. Кипящая соляная и крепкая азотная кислота, цианистый калий растворяют CuS, то же немного и сернистый аммоний; на воздухе она окисляется, переходя в CuSO 4; при сильном накаливании переходит в Cu 2 S. Водород и окись углерода при накаливании восстанавливают ее. Кроме Cu 2 S и CuS указывают на существование многосернистых соединений М., которые получаются при осаждении медных солей многосернистыми щелочами, но они мало изучены.
Кислородные соли. Известны гл. обр. соли, отвечающие окиси М.; соли закиси малопрочны и плохо исследованы. Окись М., хотя принадлежит к слабым основаниям, однако, легко соединяется даже с самыми слабыми кислотами; в то же время она образует легко основные и двойные соли. Соли окиси М. бывают обыкновенно окрашены (синего, голубого, зеленого цвета). Азотно-медная соль C u(NО 3)2 получается при растворении M. CuO или углемедной соли в азотной кислоте, при испарении раствора около 20—25° выделяются кристаллы с 3 частицами воды Cu(NО 3)2 + 3H2 O, а ниже 20°, Cu(NО 3)2+6H2 O; последняя при высушивании в разреженном пространстве легко выделяет 3 частицы воды. Cu(NО 3)2 +3Н 2 О легко растворима в воде и спирте. Она малопрочна, и из нее нельзя нагреванием выделить воду без разложения: при 114° она плавится, при 170° уже выделяет элементы азотной кислоты, образуя основные соли; при прокаливании переходит в CuО. Было указано (Ричард и Роджерс), что полученная таким образом окись М. удерживает значительное количество газов, так что, когда идет вопрос о получении совершенно чистой CuO (как, напр., для определения атомных весов), этот путь совершенно непригоден. Cu(NО 3)2 + 3Н 2 О взрывает при нагревании с углем, а смешанная с фосфором — при ударе; при выпаривании раствора Cu(NО 3)2 + 3Н 2 О и NH 4NO3 тоже происходит взрыв. Основные азотно-медные соли образуются как при действии высокой темп. на Cu(NО 3)2 + 3Н 2 О, так и при растворении в ее растворах Cu(НО) 2, CuСО 3 и даже металлической М. Из них можно назвать Cu(NО 3)2 + 3(CuН 2 О 2), соединение мало растворимое в воде, но вообще, подобно другим основным солям М., они мало изучены. Азотисто-медная соль Cu(NO2)2 получается двойным разложением медного купороса CuSO 4 и азотисто-кислого бария или свинца. Она малопрочна, на воздухе окисляется, и растворы ее постепенно разлагаются, выделяя окись азота. С углекисл. М. дает исключительно основные углемедные соли. Они не растворимы в воде и служат для приготовления красок. Осаждая раствор медного купороса содой на холоде, получают рыхлый осадок голубого цвета CuCOЗ CuO + 2H2 O. При легком нагревании он зеленеет, теряет частицу воды и переходит в малахит CuСО 3 + Cu(НО) 2; при дальнейшем нагревании он теряет элементы угольной кисл. и воду и дает соединения, еще более основные. В природе встречается соединение состава 2CuCO 3 + CuOH2 O, азурит, медная лазурь, в виде призм одноклиномерной системы. Дебрэ получил ее при действии раствора азотно-медной соли на мел в запаянных трубках на холоде при давлении 3 — 4 атмосфер. Из медных солей, вообще говоря, наибольший интерес представляют соли, отвечающие серной кислоте. Безводная серно-медная соль CuSO4 получается при нагревании медного купороса CuSO 4 + 5H2 O выше 200° в токе сухого воздуха. По некоторым указаниям, при выделении последних следов воды уже происходит, отчасти благодаря высокой темп., разложение CuSO 4. При сильном накаливании CuSO 4 выделяет SO 3 и О и переходит в СuО, хотя удалить последние следы серной кисл. невозможно. Уголь и водород при нагревании восстанавливают ее до металла. CuSO 4 жадно поглощает влагу и служит в лабораторной практике для высушивания. Она поглощает также HCl и NH 3 (см. ниже). Медный купорос CuSO4 + 5H2O получается при растворении М., окиси М., углемедной соли и пр. в серной кисл. и последующей кристаллизацией полученных растворов. CuSO 4 + 5H2 O выделяется в виде синих кристаллов триклиномерной системы и хорошо растворимых в воде. 100 частей воды растворяют CuSO 4 + 5H2 O при 0° — 31,61 частей, при 10° — 36,95, при 20° — 42,31, при 30° — 48,81, при 40° — 56,90, при 50° — 65,93, при 60° — 77,39, при 70° — 94, при 80° — 118,03, при 90° — 156,44, при 100° — 203,32 (Poggiale). Абсолютный спирт не растворяет медного купороса, но водный его немного растворяет. Глицерин растворяет при 15° около 30 частей на 100. CuSO 4 + 5H2 O выветривается в сухом воздухе, выделяя 2H 2 O при обыкновенной темп.; при 100° он теряет еще 2H 2 O. Для CuSO 4 известны гидраты с 1, 2, 3, 5, наконец, с 6 и 7 частицами воды. Гидрат CuSO 4 + 7H2 O получается, когда пересыщенный раствор медного купороса кристаллизуется в присутствии кристаллика железного купороса, a CuSO 4 + 6H2 O — в присутствии кристаллика серно-кислого никеля. Медный купорос (см.) находит многообразное применение в практике. Для CuSO 4 известен ряд основных солей. Они образуются при действии высокой температуры на CuSO 4 или при действии щелочи. Некоторые из них встречаются в природе. Для CuSO 4 известно множество двойных солей: (NH 4)2Cu(SO4)2 + 6H2O, K2Cu(SO4)2 + 6H2 O и пр. Медные соли, подобно солям многих других металлов, напр. Hg, Рt, Ag, Zn, Со и пр., дают многочисленные соединения с аммиаком. Общий вид их CuX 2nNH3 или Cu 2X2nNH3, соответственно двум типам медных соединений. В состав их может входить также некоторое число частиц воды, и они могут соединяться с кислотами. Соединения эти не отличаются большой прочностью; они сравнительно легко выделяют аммиак при нагревании и при растворении в большом избытке воды, и чем больше в них находится аммиака, тем прочность их меньше. Одни рассматривают эти соединения как отвечающие соединениям аммония (NH 4), в котором часть водорода заменена М.; напр., замещая два атома водорода в двух частицах аммония М., получим Сu(NH 3)2 [или Сu 2(NH3)2 ], двухатомную группу, замещающую в кислотах 2 атома водорода, так что, напр., хлористо-водородная соль будет Сu(NH 3)2Cl2 = CuCl22NH3 и пр. В группе Cu(NH 3)2, со своей стороны, атомы водорода могут, по этой теории, замещаться аммонием, так что является возможным образование двухатомного радикала вида Cu(NH 3)n [или Cu 2(NH3)n], где n совершенно неопределен. Другие видят в них соединения пятиатомного азота, например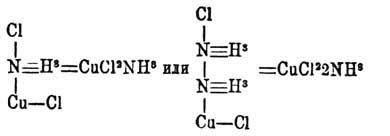
и пр. В других случаях вместо Сu фигурирует двухатомная группа Сu—Сu, одним своим сродством связанная с азотом. Наиболее естественным представляется третий взгляд на аммиачные соединения М., поддерживаемый проф. Менделеевым. Он видит в них соединения, подобные соединениям с кристаллизационной водой; они определяются теми же, еще малоисследованными силами. Это сходство нагляднейшим образом проявляется в том, что часто аммиак в таких соединениях замещается водой и обратно. Напр., пропуская через безводную CuSO 4 аммиак, получают CuSO 45NH3, аналогично CuSO 4 5Н 2 О; во влажном воздухе оно дает CuSO 4NH3H2O и CuSO 42NH33H2 O; известно также CuSO 4NH3H2 O и пр. Раcсмотрим некоторые из аммиачных соединений М. Для растворения безводной СuО в водном аммиаке требуется, по-видимому, присутствие аммиачных солей; гидрат же растворяется очень легко; полученному соединению приписывается состав CuO4NH 3 + вода. Подобное же соединение происходит при действии водного аммиака на М. в присутствии воздуха. Кислород воздуха частью окисляет М., частью окисляет NH 3 в азотистую кислоту, которая дает с избытком NH 3 азотисто-аммиачную соль. Реакция сопровождается значительным разогреванием. Аммиачный раствор окиси М. синего цвета. При действии на него М. без доступа воздуха он постепенно обесцвечивается; в растворе тогда предполагается существование соединения Cu 2O(NH3)4. Оно очень жадно поглощает кислород, окись углерода, ацетилен и во многих случаях действует как энергичный восстановитель. При действии аммиака на Cu 2 Сl 2, смотря по температуре, получаются соединения с 4, 2, 1 частицами аммиака. Эти вещества легко окисляются и присоединяют НСl соответственно в количестве 4, 2, 1 частицы. Для CuC 2 известны соединения с 6, 4, 2 частицами аммиака; для CuBr 2 c 5, 3 частицами; Сu 2J2 дает Сu 2J2 4NН 3; при действии аммиачного раствора окиси М. на спиртовой раствор йода в йодистом калии получаются соединения СuJ 2 4NН 3, СuJ 2 NН 3J2, СuJ 2 4NН 3J4 и пр. Для CuSO 4, кроме указанных, известны соединения с 2 частицами NH 3 и пр .
Анализ медных соединений. Для качественного определения М. в ее соединениях могут служить следующие реакции (имея в виду лишь соединения окиси М., так как закисные встречаются только в специальных условиях). Прежде всего, выделение М. в металлическом виде. В слабый, слегка подкисленный раствор медной соли опускают кусочек железа или цинка, обернутый платиновой проволокой; на ней выделяется М. Соединения М., внесенные на платиновой проволочке в пламя бунзеновской горелки, окрашивают его в зеленый цвет. Лучше всего это удается с хлорной M. CuCl 2; поэтому пробу смачивают соляной кислотой. При сплавлении с бурой на платиновой проволоке в окислительном пламени М. дает зеленое стекло, которое при охлаждении становится синеватым; в восстановительном пламени (лучше с прибавкой станиоля) стекло получается красным (при охлаждении). Одна из характернейших реакций на М. состоит в образовании с желтой солью красно-бурого осадка железисто-синеродистой M. Cu 2Fe(CN)6. Слабые кисл. не разлагают его; щелочи разлагают. Для характеристики может служить образование гидрата окиси М. или углекислой соли голубого цвета при действии NaНO или Na 2 СO 3, образование CuS, образование белых осадков синеродистой и роданистой М. CuCN и CuCNS, отвечающих закиси и получающихся при действии KCN или KCNS на соли окиси М. в присутствии сернистого газа SO 2. В слабых кислотах они не растворимы. CuCN растворяется в KCN. Можно указать, наконец, на образование синих растворов с аммиаком, как на одну из наиболее характерных и чувствительных реакций на М. См. также ст. Микрохимия. Для количественного определения М. существует несколько способов. 1) Определение в виде металлич. М. Для этого М. берется в виде CuSO 4 или CuCl 2 (с некоторым количеством свободной кислоты) и помещается во взвешенную платиновую чашку; сюда же кладется кусочек чистого цинка, и чашка накрывается стеклом. Водород не должен выделяться бурно. М. получается в виде бурого осадка. Убедившись в полноте осаждения и дав цинку раствориться, М. промывают декантацией горячей водой и затем спиртом, сушат при 100° и взвешивают. То же самое получают, подвергая раствор медной соли электролизу слабым током (см. Электрохимический анализ). 2) Определениe в виде СuО. Раствор нагревают до кипения в платиновой чашке и осаждают едким натром. Осадок нагревают до кипения, пока он не сделается черным; его промывают сначала декантацией и затем на фильтре. Осадок высушивают и прокаливают в платиновом тигле; фильтр сжигается отдельно. При этом способе необходимо, чтобы растворы были слабы, иначе осадок будет заключать неразложившуюся медную соль и, кроме того, его будет трудно промыть. 3) Наибольшей точностью обладает определение М. в виде Cu 2 S. Осадив М. сероводородом в виде CuS, осадок быстро промывают сероводородной водой, чтобы он не окислился на воздухе, высушивают его и помещают в тигель Розе из неглазурованного фарфора; фильтр сжигается отдельно и тоже кладется в тигель. Тигель слегка прокаливается в струе водорода, который с помощью фарфоровой трубочки вводится внутрь его через отверстие, имеющееся в крышке. Когда имеется М. в виде окиси, серно-кислой, углекислой М., Cu(SCN) (как бывает при анализе), вообще в соединении с летучими кислотами, можно прямо смешать вещество с серой и прокаливать вышеуказанным образом. Существует множество способов и для объемного определения М., напр. осаждают М. йодистым калием в виде Сu 2J2 и титруют выделившийся йод, например
2CuSO4 + 4KJ = Cu2J2 + 2K2SO4 + J2;
в других случаях титруют хлористым оловом SnCl 2 , например
2CuCl2 + SnCl2 = Cu2Cl2 + SuCl4;
конец указывается обесцвечиванием раствора; титруют также желтой солью и проч. Отделение М. от металлов щелочных, щелочно-земельных, алюминия, железа, марганца, цинка, кадмия, хрома, кобальта и никеля производится на основании нерастворимости CuS в слабых кислотах; от олова, мышьяка, сурьмы, золота и платины — на основании нерастворимости CuS в сернистом аммонии. От серебра М. отделяется на основании нерастворимости в воде AgCl, от свинца — на основании нерастворимости в воде PbSO 4. От Ag, Hg и Cd М. отделяется на основании растворимости CuS в KCN; для этого вещество растворяется в KCN и осаждается сероводородом. М. остается в растворе.
С. Вуколов. Δ.
Медные руды. Месторождения медных руд встречаются в породах почти всех формаций; но более обильны в пермских и лиасских формациях. Самородная М. встречается в отдельных массах иногда значительных размеров или в виде тонких пластинок и волокнистых отложений; также в виде песка или мелких зерен, смешанных с кварцем. Самородная М. тягуча, ковка и чрезвычайно вязка; в большинстве случаев она очень чиста, но иногда содержит незначительное количество серебра; чилийская М. содержит 7 — 8% серебра. Самородная М. встречается в Соед. Шт. Сев. Америки (на берегах Верхнего озера), в Бразилии, Чили, Перу, Сибири, на Урале, Фарерских о-вах и в Англии. Красная медная руда (Сu 2 O). В чистом виде содержит 88 — 73% M. Она встречается в крупных массах или зернах. Местонахождения ее: Корнваллис, Нью-Джерси, Урал, Алтай, берега Верхнего озера, Южная Америка и Австралия. Черная медная руда (СuO). Содержит 79,8% М., но редко бывает чистой. Руда эта встречается на берегах Верхнего озера, в Саксонии, Чили и в знаменитых рудниках "Бура-Бурра" в Австралии. Медный колчедан (CuFeS2). Это самая распространенная медная руда. В чистом виде она содержит 34,81% М., но среднее содержание руды не превышает 7 — 8%. Руда эта имеет желтый металлический оттенок и отличается от железного колчедана меньшей твердостью. Месторождения его находятся в Испании, Англии, Швеции, Саксонии, Австралии, Сев. и Южн. Америке, на Кавказе и Урале. Малахит (СuСO 3 + CuOH2 O) содержит 57% М. Он встречается в виде массивных слоистых желваков и намывов на Урале, в Сибири, Южн. Америке, Австралии и Соед. Штатах. Медная лазурь (2CuCO З + CuOH2 О) содержит 55,16% M. и встречается вместе с малахитом в Австралии, Корнваллисе, Франции и в Соед. Штат. Медный блеск, пестрая медная руда и серая медная руда — встречаются вместе с другими сернистыми рудами в Саксонии, Англии, на Урале и пр. Медный фальэрц представляет темно-серую, хрупкую руду, находящуюся как в виде сплошных масс, так и в виде кристаллов. Представляет сернистую медь, в которой М. более или менее замещена железом, цинком, серебром, ртутью и неопределенными количествами сернистых соединений мышьяка и сурьмы. Серебристый фальэрц иногда содержит до 30% серебра и не более 15% М., а в других случаях — лишь следы серебра и до 43% M. Фальэрц встречается в Корнваллисе, Саксонии, Венгрии, Мексике и проч. Горная зелень (водный силикат М.) и атакамит (хлорокись М.) иногда выплавляются для получения М. Первый встречается вместе с другими медными рудами в Корнваллисе, Саксонии, Новой Шотландии, Чили, Австралии, Сибири и на берегах Верхнего озера; второй тоже находится в Чили, Австралии, Саксонии и проч .
Металлургия М. Механическое обогащение руды. Предварительно, до чисто металлургической обработки, медные руды подвергаются механическому обогащению. Часто руду грубо сортируют в самом забое, но в большинстве случаев вся добытая руда доставляется на поверхность, где сначала отделяют крупную руду от рудной мелочи. Крупные куски затем раздробляются на куски весом от 2 до 3 фн. Полученная таким образом руда разделяется на 3 сорта, а именно на "богатую руду", "бедную руду" и "пустую породу". Богатая руда подвергается вторичному измельчению и разделению на 3 сорта. Эта работа обыкновенно производится женщинамию, и полученная богатая руда идет прямо к толчеям. Бедная руда первой сортировки тоже подвергается вторичному обогащению и в некоторых случаях вновь подразделяется на 3 сорта. Таким образом вся руда, кроме мелочи, приводится в 2 сорта, и выбрасывается значительная часть пустой породы. Богатую руду пропускают через дробильные валки, или толчеи, для окончательного дробления и затем пускают в серию грохотов с отверстиями от 4 до 64 шт. на кв. дюйм. Бедная руда дробится гораздо мельче богатой и впоследствии подвергается дальнейшему обогащению при промывке с помощью различных приспособлений , как то: промывальных чанов, неподвижных штосгердов, отсадочных решеток и проч.
Извлечение М. из руд производится двумя способами; огненным и мокрым путем. Огненные способы подразделяются на два главных рода: способ английский и германский. В общем, оба способа состоят из ряда последовательных операций обжигания и сплавления, посредством которых сера и другие посторонние вещества постепенно выделяются. Но способы эти явно различаются. По английскому способу операция производится в отражательных печах, совершается сравнительно быстро, но требует сложных манипуляций и опытных рабочих. Она кончается восстановлением М. вследствие взаимодействия окиси М. и сернистой М., например CuS+2СuО=3Сu+SО 2. По германскому способу операция, наоборот, идет медленно. Обжигания производятся в открытых кучах, в стойлах, в шахтенных печах или в особенных обжигательных печах, как то: печах Герстенгофера, Спенса, Брюкнера и пр. Сплавления же производятся в невысоких шахтенных печах. Этот способ выгоднее для бедных и нечистых руд и оказывается более экономичным, где топливо дорого. В главных чертах, германский способ, как практикующийся в Саксонии, Соед. Штатах и на Кавказе для обработки сернистых руд, состоит из следующих операций. 1) Обжигание руды в кучах от 50 до 100 тонн. 2) Плавка на купферштейн. Обожженная руда смешивается со шлаком, полученным в следующей плавке и кремнистыми флюсами, в отношении 10 частей руды, 5 частей шлака и 1 части флюса, и плавится в шахтенной печи. При этом окись железа переходит в шлак, благодаря его сродству к подмешанному кремнезему, и М. в виде сернистой М., или "купферштейна", плавится, собираясь под шлаком. 3) Обжигание купферштейна. Полученный в предыдущей операции купферштейн измельчается и обжигается для дальнейшего окисления железа и проч. 4) Плавка на более богатый купферштейн. Обожженный купферштейн подвергается вторичному сплавлению в шахтенных печах, с кремнеземистыми шлаками и флюсами. При этом содержание М. возвышается до 45 — 50%. 5) Обжигание концентрированного купферштейна. Здесь окисление производится более совершенно, чем в предыдущем обжигании. 6) Плавка на черную М. При этой плавке часть М. уходит в так наз. дюннштейн, в котором содержится почти вся сера, заключавшаяся в купферштейне. Дюннштейн содержит около 65% М. 7) Обжигание дюннштейна. 8) Вторая плавка на черную М. и дюннштейн. 9 — 10) Обжигание дюннштейна и новая плавка на черную M. 11 — 12) Рафинирование черной М. Оно производится или в открытых горнах с дутьем, или в шплейзофенах. При этом все примеси, как то: железо, свинец, никель, кобальт, сурьма и сера, окончательно окисляются и удаляются в шлак. Понятно, что приемы германского способа и ход операции много изменяются, смотря по местностям. Напр. в Соед. Штатах плавка производится в шахтенных печах с железным кожухом, обложенным кирпичами и снабженным так наз. водяной рубашкой. Последняя лежит около фурм и состоит из ряда пустых чугунных или железных ящиков, через которые свободно течет вода, благодаря этому температура стен этой части печи никогда не превышает 70°С, хотя внутри поддерживается самый сильный жар. Последнее видоизменение представляет печь Гересгофа. Она имеет вид усеченной пирамиды почти квадратного сечения, которая широким основанием лежит кверху; выс. 10 фт., шир. на дне 3 фт. 7 дюймов и 7 фт. 4 дюйма в верхней части. Число фурм 13. Водяная рубашка из котельного железа и представляет кольцеобразное пространство — 2 дюйма толщ. Дно печей тоже железное с подкладкой из песка. Печь стоит на чугунных колоннах и снабжена устройством для автоматического выпускания шлака и купферштейна. На Урале, Кавказе и в Швеции употребляют прямоугольные кирпичные печи высотой ок. 20 фт.
Английский или валлийский способ. В этом способе смешивают сравнительно бедные сернистые руды, содержащие значительное количество железа и от 5 до 15% М., с богатыми рудами того же состав
| "БРОКГАУЗ И ЕФРОН" >> "М" >> "МЕ" >> "МЕД" >> "МЕДЬ" |
Статья про "Медь" в словаре Брокгауза и Ефрона была прочитана 2296 раз
| Коптим скумбрию в коробке |
| Салат с Кальмарами |
TOP 15
- Волос
- Проно
- Степные животные
- Гимнастика
- Индийский океан
- Архитектура
- Сравнение, в литературе
- Манда
- Клитры
- Колесование
- Испарение
- Травоядные животные
- Оплодотворение у pacтений
- Вредные насекомые
- Электризация тел