


БНБ
"БРОКГАУЗ И ЕФРОН" (121188)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Малоновая кислота
Определение "Малоновая кислота" в словаре Брокгауза и Ефрона
Малоновая кислота (метандикарбоновая кислота) 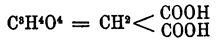 — впервые была получена Дессенье в 1858 г. окислением яблочной кислоты (acidum malicum), откуда и получила свое название. В природе она находится в соке репы. Получают М. кислоту обыкновенно из уксусной кислоты СН 3.СОHО, переводя последнюю в монохлороуксусную кислоту CH 2 Cl.COHO, которая с цианистым калием дает цианоуксусную кислоту CH 2.CN.COHO, и затем обмыливают цианоуксусную кис.:
— впервые была получена Дессенье в 1858 г. окислением яблочной кислоты (acidum malicum), откуда и получила свое название. В природе она находится в соке репы. Получают М. кислоту обыкновенно из уксусной кислоты СН 3.СОHО, переводя последнюю в монохлороуксусную кислоту CH 2 Cl.COHO, которая с цианистым калием дает цианоуксусную кислоту CH 2.CN.COHO, и затем обмыливают цианоуксусную кис.:
CH.2CN.COOH + 2H2O = CH2(COHC)2 + NH3.
М. кислота кристаллизуется в табличках трехклиномерной системы и плавится при 133° -134°. Если ее нагревать в разреженном пространстве несколько ниже температуры плавления, то она сублимируется, не изменяясь. 100 частей воды растворяют при 16°138 частей кислоты. В спирту М. кислота также легко растворима. При нагревании до температуры 140° -150° М. кислота разлагается на углекислый газ и уксусную кислоту:
CH2(COOH)2 = CO2 + CH3.COOH.
М. кислота образует два ряда солей: кислые, напр. COOH.CH 2.COONa, и средние, напр. CH 2.(COONa)2, чем и доказывается ее двухосновность. Соли щелочных металлов хорошо растворяются в воде, соли же других металлов в воде очень мало или вовсе не растворимы. Строение М. кислоты вытекает из способа ее получения.
Особый интерес и огромное значение для синтезов многих органических кислот представляют эфиры М. кислоты. Они способны реагировать с металлическим натрием, при чем выделяется водород, а натрий становится на место водорода метиленовой группы, напр.:
(C2H5.O.CO)2CH2 + Na = (C2H5.O.CO)2CH2 Na + H. Мононатрмалоновые эфиры вступают в двойное разложение с галоидными соединениями, образуя монозамещенные эфиры:
(C2H5.O.CO)2CH2 Na + J.СН 3 = NaJ + (C2H5.O.CO)2CH.CH.CH3.
Монозамещенные M. эфиры, в свою очередь, способны реагировать с металлич. натрием:
(C2H5.O.CO)2 СН. СН 3 + Nа = (C 2H5.O.CO)2 СNа.СН 3 + Н.
При действии галоидангидридов спиртов на полученное натровое производное образуются двузамещенные М. эфиры:
(C2H5.O.CO)2CNa.CH3 + J.C2H5 = (C2H5.O.CO)2(C2H5)С(СН 3).
Обмыливанием эфиров получаются кислоты типа R 2.C(СОНО) 2. По воззрениям Нефа, натрмалоновые эфиры следует рассматривать как непредельные соединения, например 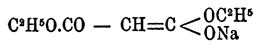 . Тогда механизм образования замещенных М. эфиров нужно представлять как последовательное присоединение галоидангидрида к натрмалоновому эфиру и затем отщепление галоидной соли натрия. Натрмалоновые эфиры получаются обыкновенно действием алкоголята натрия на М. эфиры. Средний этиловый эфир М. кислоты CH 2(COOC2H5)2 — бесцветная жидкость, не растворимая в воде, с темп. кип. 198°. Мононатриевое его производное CHNa(CO.OC 2H5)2 — твердое вещество, кристаллизующееся в блестящих иглах белого цвета. Действием на него йода в эфирном растворе получается эфир этантетракарбоновой кислоты:
. Тогда механизм образования замещенных М. эфиров нужно представлять как последовательное присоединение галоидангидрида к натрмалоновому эфиру и затем отщепление галоидной соли натрия. Натрмалоновые эфиры получаются обыкновенно действием алкоголята натрия на М. эфиры. Средний этиловый эфир М. кислоты CH 2(COOC2H5)2 — бесцветная жидкость, не растворимая в воде, с темп. кип. 198°. Мононатриевое его производное CHNa(CO.OC 2H5)2 — твердое вещество, кристаллизующееся в блестящих иглах белого цвета. Действием на него йода в эфирном растворе получается эфир этантетракарбоновой кислоты:
2(СО 2. C2H5)2 СНNa + J 2 = 2NaJ + (СО 2.C2H5)2 СН.СH(СО 2.C2H5)2.
Динатриевое производное CNa 2(CO2.C2H5)2 — густое сиропообразное, легко изменяющееся вещество, дающее при действии йода эфир этилентетракарбоновой кислоты: (СО 2.C2H5)2 С:C(СО 2.C2H5)2. Если нагревать мононатрмалоновый эфир с эфиром М. кислоты до 120° -150°, то происходит синтез эфира, принадлежащего к ряду бензола. Натрмалоновые эфиры легко разлагаются водой, сам же эфир не растворим в водных щелочах.
Хлорангидрид М. кислоты СН 2(СОСl) 2 получен действием хлористого тионила (SOCl 2) на М. кислоту. Ангидрид М. кислоты неизвестен. Из других производных известны амид CH 2(CONH2)2 и нитрил (см.) CH 2(CN)2. Кроме упомянутого уже способа получения гомологов М. кислоты из натрзамещенных ее эфиров, они могут быть получены также из предельных одноосновных кислот подобно тому, как сама М. кислота получается из уксусной кислоты. При бромировании названных кислот в известных условиях, первый атом брома всегда становится на место водорода к углеродному атому, соседнему с карбоксильной группой. Получающаяся α-бромокислота при действии цианистого калия обменивает бром на циан, и циановая группа при обмыливании дает карбоксильную группу, напр.:
C3H7.CH2.CHBr.COHO + KCN = C3H7.CH2.CHCN.COHO + KBr
и
C3H7.CH2.CHCN.COHO + 2H2O = C3H7.CH2.CH(COHO)2 + NH3.
Гомологи М. кислоты представляют твердые кристаллические вещества, растворимые легко в воде за исключением кислот, имеющих очень большую молекулу. Гомологи М. кислоты разлагаются при нагревании на углекислый газ и соответственную одноосновную кислоту:
C3H7.CH.(COOH)2 = CO2 + C3H7.CH2.COOH.
Как сама М. кислота, так и ее монозамещенные гомологи при действии крепкой азотной кислоты уже при обыкновенной температуре разлагаются с выделением углекислого газа, тогда как двузамещенные гомологи М. кислоты при действии азотной кислоты углекислого газа не выделяют. Простейший представитель гомологов М. кислоты, метилмалоновая кислота СН 3.СH(CООН) 2, носит название изоянтарной кислоты (см. Янтарная кислота).
К. Kрасуский. Δ .
| "БРОКГАУЗ И ЕФРОН" >> "М" >> "МА" >> "МАЛ" >> "МАЛО" |
Статья про "Малоновая кислота" в словаре Брокгауза и Ефрона была прочитана 3486 раз
| Коптим скумбрию в коробке |
| Куриный суп |
TOP 15
- Волос
- Проно
- Степные животные
- Гимнастика
- Индийский океан
- Архитектура
- Сравнение, в литературе
- Манда
- Клитры
- Колесование
- Испарение
- Травоядные животные
- Оплодотворение у pacтений
- Вредные насекомые
- Электризация тел