


БНБ
"БРОКГАУЗ И ЕФРОН" (121188)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Изомерия
Определение "Изомерия" в словаре Брокгауза и Ефрона
Изомерия (хим.). — В 1824 г. Либихом и Гей-Люссаком был установлен состав гремучекислого серебра (см.), при чем, на основании полученных данных, они признали безводную [Согласно господствовавшему в химии в начале нынешнего столетия взгляду, кислотами считались современные ангидриды их (см. Дуализм и Кислоты). Состав безводной кислоты выводился из данных анализа солей (в описываемом случае серебряной и ртутной), при чем считалось, что металл (в кислородных солях) входит в состав соли в виде окиси.] гремучую кислоту за соединение циана с кислородом С 4N2O2
(С = 6, О = 8, N = 14). В том же году Веллер более точными анализами солей циановой кислоты, открытой им в 1822 г., показал, что и безводная циановая кислота, по элементарному составу, представляет соединение циана с кислородом, C 2 NO (С = 6, О = 8, N = 14). Таким образом, впервые были получены вещества одного и того же элементарного и процентного состава, но различных свойств (соли гремучей кислоты взрывают с большой энергией от легкого толчка, между тем как соли циановой кислоты совершенно лишены этой способности). Хотя Гей-Люссак, реферируя в "Annales de chimie et de phisique" (27, [2], 200) работу Веллера, и указал на возможность объяснения этого явления допущением различного способа соединения между элементами, образующими гремучую и циановую кислоты, тем не менее оно настолько противоречило существовавшему в то время в химии положению, что свойства тел обусловливаются их элементарным и процентным составом, что Берцелиус, не колеблясь (в появившемся тогда новом издании своего "Trait é de Chimie"), объявил, что в данные Гей-Люссака и Либиха или Веллера вкрались ошибки; понадобились новые анализы, произведенные Либихом в 1826 г., чтобы доказать тожество состава гремучих и циановых солей. К 1826 г., впрочем, было уже известно другое, вполне аналогичное явление. Фарадей в 1825 г., исследуя жидкость, скопившуюся в цилиндрах, в которых сохранялся сдавленный светильный газ, нашел в ней, вместе с бензолом (см.), вещество (см. Бутилен) С 4 Н 8 одинакового состава с этиленом С 2 Н 4, но обладавшее удвоенной сравнительно с последним плотностью пара. Затем, в 1828 г., Веллеру удалось наблюсти, что циановокислый аммоний CNO.NH 4 (С = 12, 0 = 16, N = 14, H = 1) нацело превращается в водных растворах в мочевину (см.) CO(NH2)2, и, наконец, в 1830 г. Берцелиус, исследуя виноградную кислоту (см.), нашел, что как сама свободная кислота, так и ее свинцовая соль обладают одинаковым процентным составом с винной кислотой и виннокислым свинцом, между тем как свойства и свободных кислот и их солей довольно сильно различаются между собою (см. Винная кислота). Этими наблюдениями окончательно была установлена возможность существования различных по свойствам, но тожественных по элементарному и процентному составу, химических соединений, и в отчете по химии, представленном Шведской академии наук в 1831 г., Берцелиус замечает по этому поводу, что "так как необходимо для каждого известного представления обладать определенным выражением, выбранным по возможности рационально, то я предлагаю называть тела одного состава, но различных свойств, изомерными (от греческого слова ίσομερής — составленный из равных частей)". Уже в следующем году он дает более ограниченное определение нового понятия. "Чтобы не смешать, однако, друг с другом явления не вполне однородные", говорит он, "необходимо точно установить значение слова — И. Я считаю изомерными те тела, которые образованы из одинаковых атомов, соединенных в одинаковых относительных и абсолютных количествах, которые обладают одинаковым весом атома [Частичным весом современной химии.]. С этим случаем нельзя смешивать того, когда в двух телах содержатся одинаковые относительные количества элементарных тел, при разном абсолютном содержании этих последних. Так, напр., относительное число атомов углерода и водорода в маслородном газе (этилене) и в винном масле (бутилене) тожественно, но в одном из них содержится только один атом углерода, 2 атома водорода СН 2, между тем как в винном масле находятся 4 атома углерода и 8 атомов водорода С 4 Н 8 [Верные формулы: этилена — С 2 Н 4 и бутилена — С 4 Н 8 (С = 12, Н = 1).]. Для отличия подобных случаев одинаковости состава при различии в других свойствах, я предложил бы называть их полимерными (от греч. πολλύς — множественный и μέρος — часть)... Но существуют и другие отношения, при которых тела, по-видимому изомерные в строгом смысле этого слова, т. е. содержащие одинаковые элементы и абсолютно тожественные количества атомов, на самом деле не являются таковыми. Подобные случаи наблюдаются для тел, образованных соединением двух атомов [Под словом атом и здесь надо понимать частицу химического соединения.] первого порядка; напр. SnO.SO 3 — сернокислая закись олова, и SnO 2.SO2 — основная сернисто-кислая соль окиси олова, содержат одинаковые абсолютные и относительные количества атомов одних и тех же элементов, имеют одну и туже частицу, а между тем их нельзя считать за одно вещество. В таких телах с течением времени, или с изменением темпер., происходит обыкновенно перемещение их составных частей [Под словами "составные части" подразумеваются окислы серы и олова, которые, по Берцелиусу, существовали в описываемых соединениях как таковые. Упоминаемое превращение очень поучительно и для господствующих воззрений (см. Унитарное учение).], иногда сопровождаемое повышением темпер., вследствие чего образуются новые соединения. Чтобы резко отличить эти случаи от явлений И., можно подобные тела назвать метамерными (употребляя предлог μετά с тем же значением, которое он имеет в слове метаморфоза)". С тех пор, с развитием органической химии [Между неорганическими веществами известно очень немного изомерных веществ, и они не играли никакой роли в выработке понятия об И. Их и теперь тем удобнее оставить в стороне, что твердо установлена величина частиц слишком малого числа неорганических веществ.], фактические сведения о телах, обладающих различными свойствами при тожественном составе, чрезвычайно возросли (так, напр., в 1884 г. В. Мейер насчитал 55 различных соединений, отвечающих общей формуле С 9 Н 10 О 3, а в течение 10 лет это число значительно увеличилось), но нельзя сказать, чтобы понятия, введенные в химию Берцелиусом, выиграли в ясности и определенности. Впрочем, надо заметить, что и те примеры, на основании которых были установлены эти понятия, оказались неудачно выбранными; теперь мы знаем, что виноградная кислота обладает удвоенною частицей сравнительно с обыкновенной винною кислотою (см.), но что кроме того ее нельзя рассматривать как полимерную винную кислоту потому, что она образована соединением оптически противоположных, правой и левой винных кислот. Циановая кислота и гремучая кислота обладают тоже различной величиной частиц, при различном строении, а циановокислый аммоний и мочевина представляют тела различных функций и, по современным структурным представлениям, содержат различные группы атомов (различные остатки), а именно строение 1-го выражается формулой N:C-O.NH4, а второй — формулой NH 2.CO.NH2. Изомерными теперь называют вообще все тела одного и того же процентного состава и одной и той же частичной формулы и отличают: 1) изомеры собственно, когда при одной и той же частичной формуле вещества обладают однородной химической функцией [Так, например, изомерными считаются бутиловые спирты, отвечающие формуле C 4H10 O, именно: CH 3.CH2.CH2.CH2 (OH) — нормальный бутиловый спирт, CH 3.CH2.CH(OH)CH3 - вторичный бутиловый спирт, (CH 3)2:CH.CH2 (OH) — изобутиловый спирт и (CH3)3:C(OH) — третичный бутиловый спирт (триметилкарбинол).]; изомеры случайные, когда при одной и той же частичной формуле они обладают различной химической функцией [Примерами случайной изомерии с упомянутыми (см. пред. прим.) бутиловыми спиртами могут служить: C 2H5O.C2H5 - обыкновенный или серный эфир, CH 3O.C3H7 — метилпропиловый и метиловопропиловый эфир; формуле C 3H6 O отвечают случайные изомеры: аллиловый спирт — CH 2:CH.CH2 (OH), ацентон — CH 3.CO.CH3, окись пропилена  , окись триметилена —
, окись триметилена — 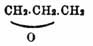 , пропионовый альдегид — CH 2.CH2.CHО и т. д.] и 3) метамеры — вещества, обладающие одной и той же частичной формулой, одной и той же химической функцией, но (как выражаются иногда) нецельной частицей [Метамерны между собою упомянутые выше простые эфиры (см. пред. прим.) или же, напр., CH 3.O2C2H3 — уксусно-метиловый эфир и C 2H5.O2CH5 — муравьино-этиловый, оба отвечающие формуле C 3H6O2 и оба случайно изомерные с пропионовой кислотою: CH 3.CH2.COOH.]. Вещества, обладающие при одинаковом процентном составе различными частичными формулами, т. е. полимерные между собой, не причисляются более к изомерам (см. Полимерия). Такое деление, однако, далеко не общепринятое. Очень часто, напр., спирты и эфиры одной с ними частичной формулы (см. прим.) назыв. метамерными соединениями (Бернтсен); в руководстве Бейльштейна "Handbuch der Org. Chemie" (3-te Aufl. S. 5): изомерами, в тесном смысле этого слова, согласно определению Бутлерова и Клауса, сочтены только соединения, в которых углеродные атомы связаны одинаково, а другие элементы сгруппированы различным образом, каковы: СН 3.СН 2.СН 2 (ОН) — пропиловый спирт и СН 3.СН(ОН).СН 3 — изопропиловый спирт; метамерными же названы соединения, в которых углеродные атомы связаны различным образом, а тожественно сгруппированы остальные, соединенные с углеродом элементы, и как примеры приведены СН 3.СН 2.СН 2.СН 2 (ОН) — нормальный бутиловый и (СН 3)2:СН.СН 2 (ОН) — изобутиловый спирты; наконец, изометамерными названы изомеры, в которых и углеродные атомы, и атомы остальных элементов связаны различным образом, как, напр., в нормальном бутиловом спирте — СН 3.СН 2.СН 2.СН 2 (ОН) и в триметилкарбиноле — (CH3)3:C(OH). Неудобство такого определения совершенно ясно; приняв его, мы должны признать, что между углеводородами возможны только случаи метамерии и изометамерии, а это совершенно несогласно с установившимся обычаем. Можно было бы привести еще несколько аналогичных примеров не менее произвольных определений (и основанных на них классификаций); достаточно, однако, и перечисленных, чтобы видеть, что значения, приобретенные словами: И. и метамерия, значительно уклонились от того смысла, который им придавал Берцелиус и который они должны иметь по самому словопроизводству. Строго говоря, раз, по современным воззрениям, мы допускаем возможность знать ближайшее распределение элементов в частицах данного вещества — его "структуру" (см. Строение хим. и Стереохимия), то изомерами, в органической химии, по крайней мере, можно называть только те тела, структурные формулы которых содержат одни и те же группы атомов, т. е. тожественные остатки: СН 3,СН" 2, СН"', СО", (СОН)', (СООН)', (ОН)',О" и т. д.; метамерными же, в смысле Берцелиуса, можно называть только тела, способные к превращению друг в друга с сохранением одной и той же величины частицы. При таком определении, изомерами из числа бутиловых спиртов (см.), напр., являлись бы только (СН 3)2:СН.СН 2 (ОН) — изобутиловый спирт, и СН 3.СН 2.СН(ОН).СН 3 — псевдобутиловый (вторичнобутиловый) спирт, метамерами же, если ограничиться уже приведенными примерами — циановокислый аммоний и мочевина. Для огромного, однако, числа веществ, теперь причисляемых к изомерным, не было бы соответственного названия, и потому заслуживают большего внимания следующие предложения Армстронга. Он предлагает называть все случаи различия свойств веществ, при тожестве их состава, не И., а аллотропией (от греческого άλλότροπος, что значит — обладающий отличными свойствами [Слово аллотропия предложено в 1841 г. Берцелиусом для характеристики различных (по физическим и химическим свойствам) видоизменений элементарных тел, каковы, напр., различные видоизменения серы. (см.), фосфора (см.) и т. д. В том смысле, в котором предлагает его употреблять Армстронг, оно довольно близко подходит, по содержанию, к слову "аллоизомерия" (от греч. άλλος— другой и ίσομερής), предложенному Михаэлем, для отличия тех случаев различия в свойствах тожественных по составу органических соединений, когда, по большинству наблюденных превращений, им приходится придавать одну и ту же структурную формулу (подробнее см. Стереохимия)], слово же И. употреблять в том тесном смысле, который только что изложен, включая следовательно сюда и все явления пространственной И. (см. Стереохимия), вещества же аллотропичные (изомерные), но различные по функции или по типу, к которому они принадлежат, Армстронг называет гетерометричными [От ητέρος — другой и μέτρον — мера.], оставляя название метамерных или изодинамичных [От ίσος — равный и δύναμις— сила.] для тех из них, которые превращаются друг в друга с исключительной легкостью. Все же остальные случаи, где аллотропичные вещества обладают одной и той же функцией, но образованы соединением нетожественных групп, он считает возможным называть изономичными [От ίσος и νόμος — закон.] (см. Кеномерия, Меротропия и Таутометрия).
, пропионовый альдегид — CH 2.CH2.CHО и т. д.] и 3) метамеры — вещества, обладающие одной и той же частичной формулой, одной и той же химической функцией, но (как выражаются иногда) нецельной частицей [Метамерны между собою упомянутые выше простые эфиры (см. пред. прим.) или же, напр., CH 3.O2C2H3 — уксусно-метиловый эфир и C 2H5.O2CH5 — муравьино-этиловый, оба отвечающие формуле C 3H6O2 и оба случайно изомерные с пропионовой кислотою: CH 3.CH2.COOH.]. Вещества, обладающие при одинаковом процентном составе различными частичными формулами, т. е. полимерные между собой, не причисляются более к изомерам (см. Полимерия). Такое деление, однако, далеко не общепринятое. Очень часто, напр., спирты и эфиры одной с ними частичной формулы (см. прим.) назыв. метамерными соединениями (Бернтсен); в руководстве Бейльштейна "Handbuch der Org. Chemie" (3-te Aufl. S. 5): изомерами, в тесном смысле этого слова, согласно определению Бутлерова и Клауса, сочтены только соединения, в которых углеродные атомы связаны одинаково, а другие элементы сгруппированы различным образом, каковы: СН 3.СН 2.СН 2 (ОН) — пропиловый спирт и СН 3.СН(ОН).СН 3 — изопропиловый спирт; метамерными же названы соединения, в которых углеродные атомы связаны различным образом, а тожественно сгруппированы остальные, соединенные с углеродом элементы, и как примеры приведены СН 3.СН 2.СН 2.СН 2 (ОН) — нормальный бутиловый и (СН 3)2:СН.СН 2 (ОН) — изобутиловый спирты; наконец, изометамерными названы изомеры, в которых и углеродные атомы, и атомы остальных элементов связаны различным образом, как, напр., в нормальном бутиловом спирте — СН 3.СН 2.СН 2.СН 2 (ОН) и в триметилкарбиноле — (CH3)3:C(OH). Неудобство такого определения совершенно ясно; приняв его, мы должны признать, что между углеводородами возможны только случаи метамерии и изометамерии, а это совершенно несогласно с установившимся обычаем. Можно было бы привести еще несколько аналогичных примеров не менее произвольных определений (и основанных на них классификаций); достаточно, однако, и перечисленных, чтобы видеть, что значения, приобретенные словами: И. и метамерия, значительно уклонились от того смысла, который им придавал Берцелиус и который они должны иметь по самому словопроизводству. Строго говоря, раз, по современным воззрениям, мы допускаем возможность знать ближайшее распределение элементов в частицах данного вещества — его "структуру" (см. Строение хим. и Стереохимия), то изомерами, в органической химии, по крайней мере, можно называть только те тела, структурные формулы которых содержат одни и те же группы атомов, т. е. тожественные остатки: СН 3,СН" 2, СН"', СО", (СОН)', (СООН)', (ОН)',О" и т. д.; метамерными же, в смысле Берцелиуса, можно называть только тела, способные к превращению друг в друга с сохранением одной и той же величины частицы. При таком определении, изомерами из числа бутиловых спиртов (см.), напр., являлись бы только (СН 3)2:СН.СН 2 (ОН) — изобутиловый спирт, и СН 3.СН 2.СН(ОН).СН 3 — псевдобутиловый (вторичнобутиловый) спирт, метамерами же, если ограничиться уже приведенными примерами — циановокислый аммоний и мочевина. Для огромного, однако, числа веществ, теперь причисляемых к изомерным, не было бы соответственного названия, и потому заслуживают большего внимания следующие предложения Армстронга. Он предлагает называть все случаи различия свойств веществ, при тожестве их состава, не И., а аллотропией (от греческого άλλότροπος, что значит — обладающий отличными свойствами [Слово аллотропия предложено в 1841 г. Берцелиусом для характеристики различных (по физическим и химическим свойствам) видоизменений элементарных тел, каковы, напр., различные видоизменения серы. (см.), фосфора (см.) и т. д. В том смысле, в котором предлагает его употреблять Армстронг, оно довольно близко подходит, по содержанию, к слову "аллоизомерия" (от греч. άλλος— другой и ίσομερής), предложенному Михаэлем, для отличия тех случаев различия в свойствах тожественных по составу органических соединений, когда, по большинству наблюденных превращений, им приходится придавать одну и ту же структурную формулу (подробнее см. Стереохимия)], слово же И. употреблять в том тесном смысле, который только что изложен, включая следовательно сюда и все явления пространственной И. (см. Стереохимия), вещества же аллотропичные (изомерные), но различные по функции или по типу, к которому они принадлежат, Армстронг называет гетерометричными [От ητέρος — другой и μέτρον — мера.], оставляя название метамерных или изодинамичных [От ίσος — равный и δύναμις— сила.] для тех из них, которые превращаются друг в друга с исключительной легкостью. Все же остальные случаи, где аллотропичные вещества обладают одной и той же функцией, но образованы соединением нетожественных групп, он считает возможным называть изономичными [От ίσος и νόμος — закон.] (см. Кеномерия, Меротропия и Таутометрия).
А. И. Горбов. Δ .
| "БРОКГАУЗ И ЕФРОН" >> "И" >> "ИЗ" >> "ИЗО" >> "ИЗОМ" |
Статья про "Изомерия" в словаре Брокгауза и Ефрона была прочитана 2161 раз
| Пицца в сковороде |
| Крабы в кокосовом молоке |
TOP 15
- Волос
- Проно
- Степные животные
- Гимнастика
- Индийский океан
- Архитектура
- Сравнение, в литературе
- Манда
- Клитры
- Колесование
- Испарение
- Травоядные животные
- Оплодотворение у pacтений
- Вредные насекомые
- Электризация тел