


БНБ
"БРОКГАУЗ И ЕФРОН" (121188)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Гидраты
Определение "Гидраты" в словаре Брокгауза и Ефрона
Гидраты — суть определенные химические соединения, содержащие в своем составе элементы воды. Между ними различают гидраты в собственном смысле, соединения с кристаллизационной водой и некоторые растворы, обладающие свойствами определенных химических соединений. К первым принадлежат такие соединения, в которых, на основании некоторых реакций их образования и их превращений, вода принимается содержащеюся в виде водных остатков ОН (гидроксил). Таковы кислоты, гидраты оснований, или водные окиси, и спирты, или алкоголи. Общей для всех их формулой будет R(ОН) n, где R есть элемент или сложная группа атомов, например, водная окись натрия, или едкий натр Na(HO), водная окись кальция, или едкая известь Са(НО) 2, кислоты азотная NO 2 (OH), серная SO 2(OH)2, борная R(OH) 3, уксусная C 2H3 O(OH), обыкновенный винный спирт C 2H5 (HO), глицерин С 3 Н 3 (ОН) 3 и т. п. Они могут рассматриваться, как вода, в которой произошло замещение одного атома водорода каким-нибудь R, например, натрием, что видно из сопоставления формул воды и едкого натра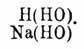
Сколько частиц воды принимало участие в замещении, столько и водных остатков находится в гидрате, например:
Число же частиц воды определяется эквивалентностью R. Такое замещение может быть воспроизведено и в действительности. Так, натрий и др. щелочные, а также щелочноземельные металлы выделяют из воды газообразный водород и дают соответствующие Г. Из других реакций их образования на первом плане следует поставить действие воды на хлорангидриды или другие галоидангидриды, так как эта реакция с ясностью показывает справедливость принятого воззрения на Г., как гидроксильные соединения, ибо здесь один атом водорода воды соединяется с атомом хлора хлорангидрида, образуя хлористый водород НCl, а остаток воды ОН вступает на место хлора хлорангидрида, образуя гидрат. Так образуется, например, серная кислота при разложении водой хлористого сульфурила:
SО 2Cl2 + 2Н 2O = SO2(OH)2 + 2НCl
или уксусная кислота из хлористого ацетила:
C2H3 OCl + Н 2 O = С 2H3 О(НО) + НCl.
Основные Г. не образуются этой реакцией, вследствие прочности по отношению к воде отвечающих им хлористых соединений. Однако, присутствие и в них водных остатков можно видеть из обратной реакции, именно получения хлористых металлов при действии хлористого водорода на основные Г., при чем водород хлористого водорода соединяется с водным остатком гидрата, образуя воду, а хлор становится на его место в гидрате, например:
Са(НО) 2 + 2НCl = СаСl 2 + 2Н(НО).
Многие Г. образуются прямым соединением безводных тел (ангидридов) с водой, напр.:
SO3 + Н 2 O = Н 2 SО 4;
СаО + Н 2 O = Са(НО) 2.
Далее, они могут получиться при реакциях двойного разложения солей с другими Г. (реакция, важная для получения Г. слабых кислотных и основных окислов, не способных прямо соединяться с водой), напр.:
CuSO4 + 2Na(HO) = Сu(НО) 3 + Na2SO4;
(NaO)2SiO3 + Н 2 SО 4 = (HO)2SiO + Na2SO4.
В подобные же реакции могут вступать и сложные эфиры; таково, например, омыление их щелочами по уравнению:
C2H3O2(C2H5) + NaHO = C2H3O(NaO) + C2H3(HO).
Наконец, Г. можно получить путем образования в соединениях водных остатков при реакциях окисления и восстановления; так уксусный альдегид (вещество ангидридное, водных остатков не содержащее), присоединяя кислород, дает уксусную кислоту, а, соединяясь с водородом, образует спирт:
C2H3 O. H + О = C 2H3O(HO);
C2H4O + H2 = C2H5(OH).
Одним нагреванием часто нельзя или трудно выделить из Г. воду, в них содержащуюся (известь, серная кислота), а иногда и вовсе нельзя даже при сильнейшем накаливании (едкий натр, метафосфорная кислота). В некоторых случаях легче достигается полное разложение гидрата, чем разложение его на воду и ангидрид (спирт, уксусная, азотная кислота). Но есть между Г. и легко теряющие воду и даже такие, которые едва способны к самостоятельному существованию. Теряя воду, многие гидраты, прежде образования ангидридов, могут переходить в ангидрогидраты, т. е. гидраты с меньшим количеством воды; так наиболее богатый водой гидрат фосфорной кислоты, ортофосфорная кислота РО(НО) 3, при нагревании до 300° образует пирофосфорную кислоту (РО) 2 (НО) 2 O, а эта последняя при прокаливании дает метафосфорную РО 2 (НО); подобным же образом для кремнезема (см.) и мн. др. существуют многочисленные ряды гидратов с постепенно убывающим содержанием воды. Будучи лишь в незначительной мере способны к реакциям прямого соединения, гидраты с легкостью, и это для них весьма характерно, вступают в реакции двойного разложения, причем их водные остатки или водород последних обмениваются на атомы галоидов, металлов и сложные атомные группы (остатки спиртов и кислот), образуя галоидангидриды, соли и сложные эфиры и выделяя воду или газообразный водород. Замещение водных остатков кислот и спиртов хлором и образование из них хлорангидридов происходит при действии РCl 5:
C2H3O(OH) + PCl3 = C2H3OCl + POCl3 + HCl;
водные основания обменивают ОН на Cl, как уже было указано выше, при действии соляной кислоты НCl, образуя хлористые металлы. Через замещение водных остатков оснований и спиртов остатками кислот при реакциях двойного разложения получаются соли и сложные эфиры:
Na(HO) + H(NO3) = Na(NO3) + Н 2O;
C2H5(HO) + H(C2H3O2) = C2H5(C2H3O2) + H2O.
Кислоты и спирты обменивают водород своих водных остатков на металлы при взаимодействии с металлами или их окисями и гидратами, причем образуются соли или алкоголяты, напр.:
H2SO2 + Zn = ZnSO4 + Н 2;
HaSO4 + ZnO = ZnSO4 + Н 2O;
H2SO2 + Zn(HO2) = ZnSO4 + 2H2O;
C2H5(HO) + Na = C2H5 (NaO) (алкоголят натрия) + H 2.
П. П. Рубцов Δ.
| "БРОКГАУЗ И ЕФРОН" >> "Г" >> "ГИ" >> "ГИД" >> "ГИДР" |
Статья про "Гидраты" в словаре Брокгауза и Ефрона была прочитана 2439 раз
| Бургер двойного помола |
| Луковый соус |
TOP 15
- Волос
- Проно
- Степные животные
- Гимнастика
- Индийский океан
- Архитектура
- Сравнение, в литературе
- Манда
- Клитры
- Колесование
- Испарение
- Травоядные животные
- Оплодотворение у pacтений
- Вредные насекомые
- Электризация тел