


БНБ
"БРОКГАУЗ И ЕФРОН" (121188)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Газы сжиженные и в критическом состоянии
Определение "Газы сжиженные и в критическом состоянии" в словаре Брокгауза и Ефрона
Газы сжиженные и в критическом состоянии — Во времена Лавуазье (см. это имя) переход Г. в жидкое и твердое состояние казался весьма вероятным, так как при химических реакциях часто совершается подобная перемена физического состояния ("Oeuvres de Lavoisier", т. II — 804). В начале XIX столетия уже было сделано несколько попыток сгущения газов. Фарадей полагает, что, напр., Нортмор еще в 1805 г. имел под руками хлор в жидком виде. Но чтобы решить вопрос, нужно было овладеть явлением сгущения газов и получить если не все, то, по крайней мере, большинство газов в жидком или твердом виде. Это выполнил Фарадей; он в 1823 и 1846 гг. сгустил известные тогда газы, кроме кислорода, водорода, азота, окиси углерода, окиси азота и болотного газа. Неудачу сгустить кислород и упомянутые газы Фарадей уже приписал тому, что не мог располагать достаточно низкой температурой. После Фарадея интерес к сжижению Г. все возрастал ввиду постоянного прибавления новых фактов, относящихся к теории газов, паров и жидкостей. Наттерер в пятидесятых годах, превзойдя большие трудности, осуществил опыты для изучения сжимаемости газов, доводя давление до 3000 атмосфер. Из этих опытов выяснилось, что при больших давлениях газы становятся все менее и менее сжимаемы. Так, при давлении в 2700 атмосфер воздух сжимается всего в 800, а водород в 1000 раз, не показывая при этом ни малейшего признака сжижения. С этого времени явилось сомнение в возможности сжижения кислорода, водорода, азота и проч., которые с тех пор и получили название постоянных газов. Здесь необходимо коснуться так назыв., критического состояния тел и критической температуры, потому что они, как увидим, имеют прямое отношение к вопросу о сжижении газов. Каньяр де Латур еще в 1822 г., нагревая эфир в запаянной стеклянной трубке, заметил, что при 190°С жидкость эта сразу обращается в пар, т. е. показал, что пар может иметь плотность, равную плотности жидкости. Тилорье заметил, что расширение жидкой углекислоты от 0° до 34° в четыре раза превосходит расширение воздуха. Работы Дриона, Менделеева и Гирна показали, что вообще у жидкостей, нагретых выше температур их кипения, находящихся под большими давлениями, коэффициент расширения сильно возрастает с температурой, достигает и даже превосходит коэффициент расширения воздуха. Так, напр., эфир при 133° расширяется как воздух, а при 190° в 1 1 /2 раза сильнее. Менделеев в 1861 г., исходя из закона уменьшения силы сцепления жидкостей при повышении температуры, пришел к следующему выводу: для всех жидкостей существует своя определенная температура, при которой сцепление частиц исчезает. А раз нет сцепления, нет и теплоты испарения, которая затрачивается на преодоление силы сцепления. Достигнув такой температуры, имеем уже не жидкость, а газ. Эту температуру, при которой из жидкости получается газ, не переходящий в жидкость при одном только увеличении давления, Менделеев назвал температурой абсолютного кипения. В 1869 г. Эндрьюс, изучая сжимаемость углекислоты при повышении температуры, нашел, что выше некоторой температуры (30°,92), которую он назвал критической, углекислота не сжижается ни при каких давлениях. Очевидно, что критическая температура тождественна с температурой абсолютного кипения и, следовательно, обладает и ее свойствами. Эти новые понятия сильно повлияли на представления о сжижении Г. До них считалось за несомненное, что тело, кроме твердого и жидкого состояния, может быть только в виде пара, насыщающего и не насыщающего пространство. Во втором случае, как известно, пары следуют законам газов. Поэтому и обратно, всякий газ считается паром, не насыщающим пространство, а потому для обращения его в насыщенное состояние и в жидкость считалось всегда достаточным одного увеличения давления. Опыты Наттерера и открытие нового состояния, в котором находятся тела при температурах, высших температуры абсолютного кипения, прямо указали на то, что так называемые постоянные газы не были сгущены только потому, что имеют сравнительно с другими газами более низкую температуру абсолютного кипения [ Это высказано было мною в Анналах Поггендорфа, в 1870 году (т. 141, стр. 623), т. е. за 7 лет до опытов сжижения так называемых постоянных газов. — Д. Менделеев. ]. Чтобы выполнить сжижение постоянных газов, оставалось определить для них, хотя бы приблизительно, эту температуру, а также иметь понятие о тех упругостях, которые будут иметь при разных температурах эти газы, будучи в состоянии насыщенных паров. В 1877 г. Кальете в Париже и Пикте в Женеве и выполнили эту задачу двумя различными методами. Врублевский и Ольшевский в 1884 г., получив в жидком виде кислород, азот и окись углерода, дали точные величины для их критической температуры. Наконец Дьюар, значительно улучшив устройство приборов, сделал эти опыты доступными для демонстрации на лекциях и для всестороннего изучения свойств жидких газов. В настоящее время не изучен в жидком виде один только водород, хотя наблюдают явления, указывающая на его сжижение в течение крайне непродолжительного промежутка времени. Причина трудности лежит в весьма низкой критической температуре водорода. Ниже мы увидим, каким образом удалось, хотя и приближенно, определить критическую температуру водорода.
Из предшествующего видна связь между сведениями о Г. в жидком и критическом состоянии, а потому, ранее чем говорить о способах сжижения, остановимся на данных о критическом состоянии. Обыкновенно физическое состояние газа или пара характеризуется тремя переменными: температурой — t, давлением — р и объемом — v. Опыт указывает соотношение между этими тремя переменными. Такое соотношение носит название уравнения состояния
pv = R(273 + t)...(1)
и соединяет в себе законы Mapиoтт a и Гей-Люссака. Следствие, из него получающиеся, в точности согласуются с наблюдениями лишь для газов, значительно удаленных от состояния сжижения и находящихся под незначительными давлениями. Для изучения же газов в более широких границах приходилось изучать разные отклонения их от этого закона. Не существующий газ, точно следующий закону (1), получил название идеального газа. В практике только недавно стали пользоваться сжиженными газами; поэтому все расчеты делались именно для этого идеального газа. В.-дер-Вальс [ См. Вальса формула ] в 1873 г. дал уравнение состояния, приложимое к газам, находящимся в состоянии газовом, парообразном и жидком. Уравнение это имеет форму аналогичную с формою уравнения (1):
(v — α)(p + β /v2) = R(273 + t)...(2).
Уравнение (1) получается из (2), полагая постоянные α и β равными нулю. Если постоянным α, β и R дадим значения, определенные для какого-нибудь газа, напр. для углекислоты, и примем переменные v р и t за координаты, то уравнение (2) определит в пространстве некоторую поверхность. Для наглядности на черт. 1 изображены кривые, получающиеся через пересечение этой поверхности плоскостями, параллельными координатным осям v и р.
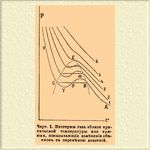
Черт. 1. Изотермы газа вблизи критической температуры или кривые, показывающие изменение объемов с переменою давлений.
Каждая из этих кривых от 1 до 6 изображает зависимость v от р при некоторой постоянной температуре. Напр., 4 кривая есть изотерма углекислоты при 31°; 5 и 6 — при высших температурах, и кривые 1, 2 и 3, имеющие волнистый изгиб, — при низших температурах. Изотермы, полученные непосредственно из опыта, почти совпадают с теоретическими на всей плоскости чертежа, кроме той его части, которая обведена пунктирной кривой; разница заключается в том, что практические изотермы не образуют здесь волнистого изгиба, а представляют лишь прямые, параллельные оси v. Напр., на чертеже линия AB αβγ CD есть теоретическая, a ABCD — изотерма по данным опыта. Дело в том, что, сжимая газ при постоянной температуре, что соответствует движению точки влево по соответствующей изотерме, напр., по изотерме 1 от точки А, мы доводим газ до состояния насыщенного пара, которое изображено точкой В. Как только образуется первая капля жидкости, дальнейшее увеличение давления становится невозможным, а объем смеси пара с жидкостью будет уменьшаться до тех пор, пока верь пар не обратится в жидкость, которая при увеличении давления становится все менее и менее сжимаема. Прямая ВС и изображает состояние газа в виде смеси жидкости с насыщенным паром, а кривая CD и ее продолжение выражают закон сжимаемости вещества уже в виде жидкости. Если же, доведя газ до упругости насыщенного пара, мы помешаем образованию первой капли жидкости, то изменение объема и давления следуют другому закону. Опыт показал реальность теоретической изотермы от В до α и от С до γ; часть же αβγ остается гипотетической. Мы видим, следовательно, что уравнение ван дер Вальса само по себе не выражает сжижения газов. Закон Клаузиуса-Томсона, очевидный с точки зрения термодинамики, пополняет этот недостаток. Этот закон состоит в следующем: прямая, параллельная оси v, изображающая смесь насыщенного пара с жидкостью, должна образовать с теоретической изотермой площади С γβ и βαВ, равные между собою. Имея уравнение состояния и этот закон, нетрудно вычислить упругость насыщенных паров при любой температуре. Что сказано относительно изотермы 1, относится и к изотермам 2 и 3. Из чертежа видно, как предельные точки, отвечающие состояниям газовому и жидкому на изотермах 2 и 3, все более и более сближаются между собой. На изотерме 4 эти точки сливаются. Пунктирная кривая таким образом ограничивает ту часть плоскости, где возможно сжижение газа. Предельная изотерма 4, очевидно, соответствует критической температуре, а точка Е изображает на чертеже критическое состояние углекислоты. Бесконечно малые изменения переменных t и р способны произвести то, что мы будем иметь или жидкость, или несжижаемый газ, или пар. Точка Е, изображающая критическое состояние, определяется по следующим условиям: 1) в этой точке касательная параллельна оси v, 2) точка Е есть точка перегиба, 3) точка Е удовлетворяет уравнению состояния. Если обозначим уравнение состояния через
F (p, v, t) = 0
то система уравнений, удовлетворяющих условиям, равносильна следующим:
(3)... F = 0; (dF) /(д v) = 0; (d2F) /(д v2) = 0.
Эти три уравнения определяют значения p, v и t, относящиеся к точке Е ; обозначим эти величины через рс , vc и tc Положим, что мы определили из двух последних уравнений р c и tc и подставили эти величины в уравнение состояния F = 0, результат подстановки, в силу уравнения (3), будет
(4)... (v — vc)3 = 0.
Первая часть этого уравнения должна быть тождественна с первой частью уравнения
F(рс vtc) = 0
приведенного к такому же виду:
v3 — [ α pc + R(273 + tc)]/[pc v2] + β v/pc - [ αβ] /pc = 0.
Сравнивая коэффициенты и определяя значение неизвестных, получаем:
vc = 3 α
pc = β /(27 α 2)
tc = (8 β) /(273 α R) — 273.
Таким образом, зная численные величины α, β и R [ Их можно узнать, производя наблюдения над газом, удаленным от сжижения, то есть, наблюдая изменения его плотности с переменою температуры или давления или их обоих вместе, или, говоря иначе, наблюдая отступления от закона (1), что произведено Реньо, Эндрьюсом, Амага, Рамзаем и Юнгом и др. для многих паров и газов. ] для какого-нибудь газа, легко можно предсказать элементы его критического состояния и, наоборот, определив из опыта vc, рс и t с, мы имеем уравнение состояния. При увеличении числа наблюдений оказалось полезным несколько дополнить уравнение Ван дер Вальса. Клаузиус в 1880 г. придал уравнению состояния вид:
p = RT/[v — a] — K/[ Т (v + β)2]
где K, α, β и R суть постоянные, а Т — абсолютная температура, равная (273 + t). Наконец, Сарро в 1885 г. дал формулу:
p = RT/(v — a) — (Ke — T)/(v + b)2.
Результаты, получаемые по этой формуле, замечательно близки к действительности. Например, для углекислоты Сарро получил из уравнения состояния, в котором постоянные определялись на основании сжимаемости углекислоты в газообразном состоянии, следующие числа: tc = 32°,7, рс = 75,64 атм., между тем как опыт дает: t с = 31° и рс = 77 атм.
Подобным же образом Сарро определил вычислением рс и tc для следующих газов:
| pc | tc | |
| Кислород | — 105,4 | 48,7 |
| Азот | — 124,0 | 42,1 |
| Водород | — 174,0 | 98,9 |
Наблюдения Врублевского и Ольшевского, Дьюара и др. дают числа довольно близкие к этим. Приводим величины tc и рс для некоторых, наиболее известных тел, заметив, что точное определение этих величин из опыта представляет большие экспериментальные трудности.
| Темп. абс. кип. или критич. °C tc | Критич. давл. в атм. pc | |
| Кислород | — | 113 50 |
| Азот | — 145 | 35 |
| Хлор | + 141 | 83,9 |
| Вода | + 365 | 200,5 |
| Сернистый водород | + 100,2 | 92,0 |
| Аммиак | + 130,0 | 115,0 |
| Закись азота | + 35,4 | 75,0 |
| Окись углерода | — 141,0 | 35,0 |
| Сернистый газ | + 155,4 | 78,9 |
| Этилен | + 10,1 | 51,0 |
| Эфир | + 195,5 | 40,0 |
| Болотный газ | — 99,5 | 50,0 |
Способы сжижения газов. Опыты Фарадея в 1823 году ["Phil. Trans.", 1823, 16v.]. Для получения какого-нибудь газа в жидком виде, Фарадей подыскивал твердые или жидкие тела, которые, при н a гревании в запаянной трубке, выделяют желаемый газ. Прибор Фарадея состоял из стеклянной загнутой сифоном трубки, в одном конце которой помещалось соответствующее вещество (например, для получения аммиака — соединение аммиака с хлористым серебром), в другом конце сифона помещался небольшой манометр со сжатым воздухом, который мог измерять давление внутри трубки. Этот второй конец трубки запаивался и помещался в охладительную смесь (фиг. 2).

Фиг. 2. Прибор Фарадея для сжижения газов в запаянной трубке.
Нагревая первый конец трубки и образуя таким образом все новые и новые количества газа, Фарадей этим самым увеличивал давление внутри трубки. При достаточном давлении, в охлажденной части прибора появлялся сжиженный газ. Таким образом Фарадей мог получить в жидком виде следующее газы:
| Темп. °C | атм. давл. | |
| Сернистая кислота | 7,2 | 3,0 |
| Сернистый водород | 10,0 | 17,0 |
| Углекислота | 0,0 | 36,0 |
| Закись азота | 7,2 | 50,0 |
| Синерод | 7,2 | 3,7 |
| Хлористо-водородный газ | 10,0 | 50,0 |
| Хлор | 15,5 | 4,0 |
Способ Тилорье для получения жидкой и твердой углекислоты [Tilorier, "Ann. de Chimie et de Phys.", 60 — 427, 1835.]. Для получения жидкой углекислоты, в больших сравнительно количествах, Тилорье устроил прибор (фиг. 3), состоящий из двух совершенно одинаковых сосудов, емкостью около 1/4 куб. фута каждый.
Фиг. 3. Прибор Тилорье для получения жидкой углекислоты.
Один из этих сосудов служил как приемник жидкой углекислоты, в другом же получался газ из двууглекислой соды и серной кислоты, которая вливается в раствор соды только при наклонении сосуда. Выделяющаяся углекислота, при помощи соединительной трубки, перегонялась в охлаждаемый приемник, где и собиралась в жидком виде. Два несчастных случая, происшедшие от разрыва прибора, заставили избегать этого способа в лабораториях. При 20°С упругость паров жидкой углекислоты равна 58 атмосферам. Следовательно, если будем выливать жидкую углекислоту наружу, где давление равно одной атмосфере, то жидкость, во-первых, разобьется в пыль, а во-вторых, будет кипеть. При кипении жидкости, а также при расширении газа (когда при расширении совершается работа), как известно, происходит большое поглощение тепла; поэтому жидкая углекислота, по выходе из резервуара вследствие обеих упомянутых причин сильно охлаждается и частью замерзает. Если выпускать жидкую углекислоту прямо на воздух, то раздробленная жидкость частью замерзает в вид e очень мелких снежинок, и виден белый туман, который быстро рассеивается в воздухе. Собрать твердую углекислоту можно, выливая ее, как это иногда делается, в шерстяной мешок; при этом вследствие трения углекислоты (жидкой) об шерсть последняя сильно электризуется. Чтобы по возможности устранить потерю углекислоты при выпускании, Тилорье предложил употреблять особый прибор, изображенный на фиг. 4.
Фиг. 4. Прибор для получение твердой углекислоты при быстром испарении струи жидкой углекислоты.
Он состоит из двух латунных воронок, которые складываются вместе и закрепляются штыковым запором. Жидкая углекислота впускается струею внутрь этого прибора, так что жидкость разбрызгивается и, быстро испаряясь, отчасти замерзает; газ же выходит в отверстия, расположенные среди рукояток, которые для предохранения рук от холода обложены сукном. Твердая углекислота имеет вид снега и при атмосферном давлении испаряется весьма медленно, имея температуру около — 80°. Для сильного охлаждения Тилорье предложил смешивать твердую углекислоту с эфиром, который, сам не замерзая, увеличивает проводимость смеси.
Насос Наттерера. Для получения жидкой углекислоты и других газов в лабораториях чаще всего берут насос Наттерера, который может сдавливать газы до 50 атмосфер (фиг. 5).
Фиг. 5. Насос Наттерера для сжижения СО 2, N2 О и др.
Сухой газ по трубке t входит в насос (который справа изображен в разрезе). Поршень насоса при помощи шатуна b и рукоятки А получает движение вверх и вниз; при своем движении вверх он сжимает газ и проталкивает его в железный сосуд R, снабженный в нижней части отворяющимся внутрь клапаном. Для устранения нагревания, резервуар, где сгущается газ, и самый насос окружены воронкой, наполняемой льдом. Накачав газ, отвинчивают резервуар от насоса, опрокидывают резервуар и при открывании винтового крана выпускают струю сжиженного газа из трубки О.
Опыты Фарадея в 1845 году ["Phil. Trans.", 1845; "Ann. de Chimie et de Ph.", 3 serie, t. XV, 257.]. В 1845 г. Фарадей стал достигать охлаждения до — 100°С при помощи смеси эфира с твердою углекислотою, испаряющеюся над колоколом воздушного насоса. Сжатие газов достигалось при помощи двух насосов; из них первый (больший) сжимал испытуемый газ до 10 атмосфер; газ, таким образом сжатый, поступал во второй насос, при помощи которого газ мог быть сдавлен до 50 атмосфер. Стеклянная трубка, в которую накачивался газ, проходила под колокол воздушного насоса; ее запаянный конец погружался в вышеупомянутую охлаждающую смесь. Располагая давлением в 50 атмосфер и температурой в — 100°, Фарадей, конечно, не мог сгустить постоянные газы, так как для азота и кислорода температуры абсолютного кипения лежат ниже — 100.
Опыты Кальете. Для наблюдения над способностью к сжижению так называемых постоянных газов Кальете их сжимал, охлаждал и затем давал им быстро расширяться, уменьшая сразу давление, чтобы через то их температура упала; при таком понижении температуры, если газ способен к сжижению, он дает капли или туман, как в том легко убедиться, взяв углекислоту или другой заведомо сжижаемый газ. Опыт показал, что и постоянные газы, после известного сдавливания и охлаждения, дают такое же явление, чем и была доказана их способность к сжижению при низких температурах.
Прибор Кальете изображен на фиг. 6.
Фиг. 6. Прибор Кальете для показания постоянных газов.
Стеклянная трубка ТТ, открытая снизу и сверху запаянная, наполняется сухим испытуемым газом и погружается в ртуть, находящуюся в железном резервуар e В, который при помощи гайки Е герметически закрывается и через трубку сообщается к насосом. Оттянутый в капиллярную трубку верхний конец стеклянной трубки ТТ, выходящий сквозь гайку E, дает возможность видеть перемену состояния газа, заключенного в ТТ. Сжатие газа достигается при помощи насоса, нагнетающего воду в резервуар В по трубке TU; вода давит на ртуть, а ртуть, входя внутрь трубки ТТ, сжимает газ. Резервуар В может при помощи особого крана V быть сообщен с наружным воздухом, что может служить для быстрого уменьшения давления газа, находящегося в ТТ. Для очень больших давлений, когда газ занимает уже незначительный объем, пользуются винтом, который, входя внутрь прибора, давит на воду. Таким образом, оказалось, что кислород, при обыкновенной температуре, при быстром уменьшении давления от 300 до одной атмосферы, образует густой туман, свидетельствующий о перемене состояния кислорода. Азот, сжатый при + 13° до 200 атмосфер, при быстром расширении образует ясно видимые капли жидкости. Наконец, водород, сжатый до 280 атмосфер, быстро расширяясь, образует вдоль по оси стеклянной трубки тонкую струйку тумана ["Comptes Rendus", 1877, LXXXV.].
Способ Пикте для сжижения газов. Одновременно с Кальете, Пикте произвел сжижение кислорода. Его метод тот же как у Фарадея, только примененный в больших размерах. Фиг. 7 показывает общее расположение приборов.
Фиг. 7. Схематическое изображение прибора Пикте для сжижения кислорода и др. газов.
А и В суть два насоса двойного действия, т. е. одновременно и всасывающие и нагнетающие; они предназначены для сернистой кислоты, находящейся в жидком виде в трубе С, в которой, вследствие разрежения сернистой кислоты, температура падает до — 65°. Пары сернистой кислоты, выкачиваемые системой насосов А и B, нагнетаются в конденсатор D, охлаждаемый льдом, где и сгущаются снова в жидкость, которая вновь поступает в трубку C по трубке d. Е и F суть насосы, тождественные с двумя первыми. В них содержится углекислота, для сжижения которой служит охлаждение, доставляемое испаряющеюся в С сернистою кислотою; углекислота, сжиженная в К от сдавливания насосами Е и F и от охлаждения, поступает в трубку Н. Здесь она испаряется под уменьшенным давлением и через это производит сильное охлаждение трубки М, необходимое для сжижения содержащегося в ней сжатого кислорода. Пары жидкой СО 2, выкачиваемые из муфты Н, сгущаются при давлении около 5 атмосфер в приемнике К, охлаждаемом до — 65° сернистой кислотой, кипящей в муфте С. L есть реторта кованого железа, могущая выдерживать давления, доходящие до 500 атмосфер. Она содержит бертолетовую соль и при нагревании выделяет кислород. Из реторты выходит толстая трубка М, около метра длиною, которая помещается внутри приемника Н, где испарение жидкой углекислоты поддерживает температуру около — 115°. На нижнем конце трубки М укрепляются (не изображенные на фигуре) манометр для измерения давлений и выпускной кран r. Через несколько часов нагревание сосуда L и непрерывного действия четырех насосов, приводимых в движение 15-сильной паровой машиной, когда давление в приборе перестало возрастать (потому что выделяющийся кислород сжижается в холодной части трубки), давление внутри трубки М достигло 320 атмосфер. Открыв быстро кран r, Пикте видел, что часть кислорода, находящегося в охлаждаемой трубке М, обратилась в жидкость и из нее выбрасывалась в виде струи ["Comptes Rendus", 1877.]. Этим же способом Пикте получил в жидком виде азот, окись углерода и др. газы.
Способ Вроблевского и Ольшевского для сжижения кислорода. Фигура 8 представляет схему расположения приборов.
Фиг. 8. Прием Вроблевского для сжижения газов.
Кислород сдавливался при помощи насоса в резервуаре кованого железа, от которого видна внизу на фигуре лишь верхняя часть b с. Загнутый коленообразно, запаянный конец трубки q, содержащей сжатый кислород, проходит сквозь каучуковую пробку в крепкий стеклянный охлаждаемый приемник s. В каучуковой пробке сделаны еще два отверстия; одно из них служит для небольшого водородного термометра r, построенного наподобие воздушного термометра Жолли; через второе отверстие проходит короткая стеклянная трубка u, имеющая форму буквы Т. Ветвь, идущая к v, соединяется с большим воздушным разрежающим насосом Бьянки. Верхний конец Т-образной трубки плотно закупорен каучуковой пробкой d, через которую проходит тонкая латунная трубка w, ведущая к резервуару наттереровского насоса х, наполненному жидким этиленом. Конец латунной трубки w, входящий внутрь приемника s, снабжен отверстиями, через которые из x втекает жидкий этилен, который, проходя из резервуара x, охлаждается в змеевике смесью твердой углекислоты с эфиром, так что этилен почти весь доходит в жидком виде. Поступив в приемник, здесь, под влиянием разрежения, производимого из v, жидкий этилен быстро испаряется и производит охлаждение до — 130°. 300 граммов этилена и 400 граммов твердой углекислоты достаточны для одного опыта. Приемник s помещается в стеклянный сосуд у, содержащий хлористый кальций, для поглощения влажности из воздуха, так что можно ясно видеть все, что совершается в трубке q. Таким образом, охладив трубку q до — 10°, удавалось обратить кислород в жидкость при давлении около 20 атмосфер. Пользуясь испарением сжиженных газов под уменьшенным давлением, Врублевский получал такие температуры:
| Температура | Давление | |
| Кислород | — 200°,4 | 2,0 мм |
| Азот | — 206°,0 | 4,2 " |
| Окись углерода | — 200°,6 | 4,0 " |
Азот и окись углерода при этих температурах замерзают ["Ann. de Chimie et de Phys.", 1884.].
Наиболее новые опыты и исследования над сжижением постоянных газов произведены Амага в Лионе и Дьюаром (Dewar) в Лондоне, при помощи последовательного сильного охлаждения, производимого испарением в разреженном пространстве сжиженных газов, легче переходящим в жидкое состояние. Таким образом, Дьюар под обыкновенным давлением превратил атмосферный воздух в жидкое состояние. В статье Холод искусственный, будут даны указания на примененные им способы.
Сжиженные газы уже начали получать немаловажное техническое значение, так что они производятся на специальных заводах и находятся в продаже. Более всего применяются сжиженный сернистый, SO2, и углекислый, СО 2, газы, тем более, что они получаются легко и в соответственных герметически запертых сосудах хорошо сохраняются даже при перевозке. Углекислый газ в жидком виде применяется не только для получения низких температур, но и для получения воды, насыщенной углекислотою (см. Минеральные воды), для поднятия (давлением) и сохранения пива, для сдавливания металлических отливок при их остывании и т. п.
Н. А. Смирнов. Δ.
| "БРОКГАУЗ И ЕФРОН" >> "Г" >> "ГА" >> "ГАЗ" |
Статья про "Газы сжиженные и в критическом состоянии" в словаре Брокгауза и Ефрона была прочитана 2395 раз
| Коптим скумбрию в коробке |
| Креветки с газировкой |
TOP 15
- Волос
- Проно
- Степные животные
- Гимнастика
- Индийский океан
- Архитектура
- Сравнение, в литературе
- Манда
- Клитры
- Колесование
- Испарение
- Травоядные животные
- Оплодотворение у pacтений
- Вредные насекомые
- Электризация тел